醫療器械臨床試驗數據遞交要求注冊審查指導原則
一�����、前言
醫療器械臨床試驗數據是評價(jià)醫療器械安全有效性的重要支持性資料之一�����。規范地收集���、整理���、分析和遞交醫療器械臨床試驗數據有助于提高臨床試驗實(shí)施和管理質(zhì)量���,同時(shí)有利于監管機構快速����、高效地掌握臨床試驗的開(kāi)展情況��,提高審評效率����。
為指導注冊申請人規范遞交臨床試驗數據及相關(guān)資料�����,以便更好地開(kāi)展臨床評價(jià)資料審評相關(guān)工作��,制定本指導原則���。
本指導原則是在現行法規和標準體系以及當前認知水平下制定的����,隨著(zhù)法規和標準的不斷完善��,以及科學(xué)技術(shù)的不斷發(fā)展���,本指導原則的相關(guān)內容也將進(jìn)行相應的調整�����。
二�����、適用范圍
本指導原則適用于以產(chǎn)品注冊為目的開(kāi)展的醫療器械臨床試驗���,包括在境外開(kāi)展的醫療器械臨床試驗�����,不適用于按醫療器械管理的體外診斷試劑臨床試驗�����。與體外診斷試劑配合使用開(kāi)展臨床試驗的體外診斷設備和軟件���,如將該臨床試驗用于該體外診斷設備和軟件的注冊申報�,可參考本指導原則提交臨床試驗數據���,亦可按照《體外診斷試劑臨床試驗數據遞交要求注冊審查指導原則》提交臨床試驗數據�。本指導原則僅涉及臨床試驗數據遞交相關(guān)內容�,不涉及臨床試驗過(guò)程中數據管理相關(guān)要求�。
三����、基本原則
(一)真實(shí)原則
所遞交的臨床試驗數據與臨床試驗原始記錄保持一致����。
(二)可追溯原則
按照注冊申請人提交的數據�����、說(shuō)明性文件和程序代碼��,可從原始數據庫重現形成分析數據庫����、臨床試驗報告中的統計分析結果��,且形成的分析數據庫和統計分析結果與注冊申請人提交的內容一致�。
(三)可讀原則
所提交數據庫結構清晰��,注釋詳盡��,便于審閱�。按照本指導原則相關(guān)規范要求遞交臨床試驗數據有助于提高可讀性����。
四�、臨床試驗數據相關(guān)資料及其說(shuō)明
醫療器械臨床試驗數據相關(guān)資料通常包括原始數據庫���、分析數據庫����、說(shuō)明性文件和程序代碼�,以下對各申報資料具體格式和內容提出要求���。鼓勵注冊申請人參照臨床數據交換標準協(xié)會(huì )(Clinical Data Interchange Standards Consortium�, CDISC)標準遞交數據���。
外文資料提供中文翻譯件時(shí)���,對于原始和分析數據集���,應至少翻譯數據集����、變量標簽����、觀(guān)測值中的描述性文本(如不良事件描述等)��。
(一)原始數據庫
遞交的原始數據庫通常包含從病例報告表和外部文件中直接收集的原始數據����,缺失的數據在此處不應進(jìn)行填補���。
原始數據庫通常由多個(gè)不同的原始數據集組成���,單個(gè)原始數據集是相同主題下多個(gè)變量的集合����,這些變量的觀(guān)測值共同形成該原始數據集���,例如�����,人口學(xué)資料數據集可包括年齡��、性別��、身體質(zhì)量指數(Body Mass Index��,BMI)等���。不同臨床試驗涉及的原始數據庫不完全相同�����。單個(gè)原始數據集應收集相同主題下的變量���,不同主題變量建議分別形成原始數據集�����,例如����,膝關(guān)節Lysholm評分和IKDC2000評分相關(guān)變量建議分別形成兩個(gè)原始數據集�����。
各數據集需包括受試者唯一標識變量��,以實(shí)現同一受試者不同數據集觀(guān)測值的關(guān)聯(lián)�����。如涉及不同訪(fǎng)視時(shí)間點(diǎn)觀(guān)測的數據�,應使用訪(fǎng)視時(shí)間變量進(jìn)行標識�����。例如�,術(shù)后3個(gè)月和6個(gè)月心臟超聲相關(guān)觀(guān)測值���,訪(fǎng)視時(shí)間標識變量可命名為Visit_3���、Visit_6等進(jìn)行區分���。若涉及兩個(gè)及兩個(gè)以上臨床試驗�,數據集中需包括臨床研究標識變量�����。若臨床試驗采用了隨機分組���,原始數據庫中應包含隨機號等變量�。
數據集和變量命名應遵循“可讀性”的原則����,建議在對其命名時(shí)參考數據集或變量的英文或拼音�,使得通過(guò)名稱(chēng)可較容易聯(lián)想到該命名的實(shí)際含義���。例如����,可參考“Medical History”將病史數據集命名為“MH”�,參考“Concomitant Medication”將合并用藥數據集命名為“CM”��,將變量“性別”命名為“sex”�,變量“受試者姓名縮寫(xiě)”命名為“sub_abbr”等��。
(二)分析數據庫
分析數據庫是為便于統計分析使用原始數據集形成的數據庫��,用于產(chǎn)生臨床試驗報告中的統計結果(包括基線(xiàn)����、療效和安全性指標統計分析等)����。分析數據庫主要包括原始數據庫中的變量數據和按照臨床試驗方案和統計分析計劃(如有)中事先確定的方法(如缺失值填補����、量表子項評分加和等)從原始數據庫變量數據衍生的數據����。
分析數據庫通常由多個(gè)不同的數據集組成���,這些數據集一般與臨床試驗報告中的統計結果相對應����。例如���,臨床試驗報告中美國國立衛生研究院卒中量表(NIHSS)評分統計結果可對應專(zhuān)門(mén)的分析數據集����,該分析數據集是為了生成NIHSS評分統計結果而專(zhuān)門(mén)創(chuàng )建的�����,包含生成該統計結果的全部變量數據��,其他不相關(guān)變量數據不納入到該數據集中����。為了便于統計分析復驗����,分析數據集中的變量應具有可溯性�����,變量結構應清晰��,不需繁瑣的數據前處理即可開(kāi)展統計分析�。
分析數據集可基于其產(chǎn)生的相應統計結果進(jìn)行命名��,例如�,生成不良事件比較結果的數據集可命名為“ADAE”(不良事件分析數據集)���。建議在分析數據集名稱(chēng)中加入“AD”(analysis data)前綴��,以標識該數據集為分析數據集���。
分析數據集變量命名同原始數據庫要求���。注意明確不同分析集(如全分析集FAS��、符合方案集PPS和安全分析集SS等)標識變量�,以及形成數據庫過(guò)程中產(chǎn)生的系統變量(如有)��,如序號�����、時(shí)間等���。
(三)程序代碼
需遞交的代碼主要包括:用于原始數據庫生成分析數據庫的代碼��、分析數據庫生成統計分析結果的代碼等���,用于調整格式或生成表格的相關(guān)代碼可不遞交���。遞交的代碼應符合通常的編程格式和編程規范�����,結構清晰明了�,易于閱讀�����。程序代碼中應包括充分的注釋?zhuān)悦枋霾煌绦虼a的目的及其他需解釋的內容��,幫助審閱者更好地理解代碼邏輯����。如果遞交的程序代碼引用了宏程序����,需提供相應的宏程序代碼���,并說(shuō)明運行該程序的軟件版本��、系統環(huán)境���。
(四)說(shuō)明性文件
1.數據說(shuō)明文件
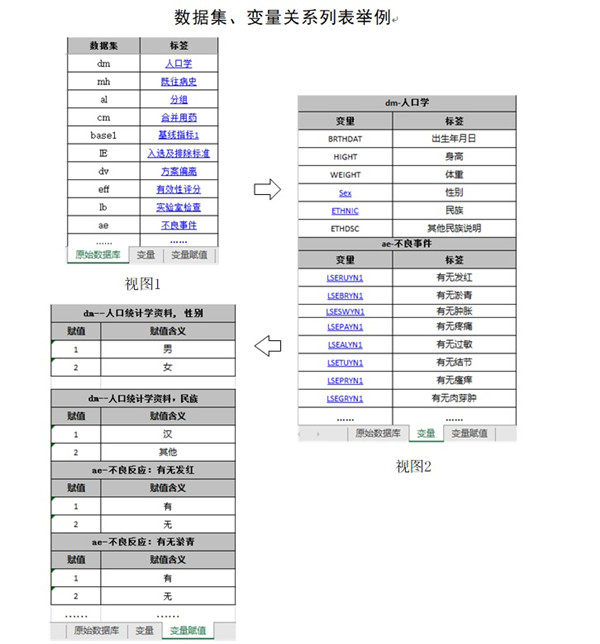
數據說(shuō)明文件用于描述原始數據庫和分析數據庫的內容和結構�,有助于審閱者快速了解數據庫中各數據集���、變量及其相互間的結構關(guān)系���,準確理解遞交的數據內容��。建議采用Excel文件���,以表格的形式分別列明原始數據庫和分析數據庫中所含的數據集��、變量���、變量類(lèi)型(如字符型���、數值型)��、標簽�����、賦值及其對應關(guān)系����,具體可參考附錄1《數據集����、變量關(guān)系列表舉例》�����。為了便于審閱���,數據集和變量應具有相應的中文標簽�,標簽長(cháng)度不宜過(guò)長(cháng)�。若使用了外部詞典(如MedDRA)��,應明確使用的外部詞典名稱(chēng)和版本號�����。
分析數據庫的說(shuō)明文件需列明衍生變量的生成規則�,明確涉及到的變量和計算方法�。例如���,對缺失值的填補�,應明確填補方法��,提供相應的程序代碼��。建議以表格的形式列明生成各分析數據集所用到的程序代碼文件和原始數據集名稱(chēng)����。
2.程序代碼使用說(shuō)明文件
程序代碼使用說(shuō)明文件用來(lái)解釋說(shuō)明程序代碼文件使用方法����、系統及軟件環(huán)境�����,包括使用代碼文件時(shí)是否需修改以及如何修改程序代碼���。同時(shí)�,以表格形式逐一列明生成各統計結果圖表所使用到的程序代碼文件和數據集文件名稱(chēng)��。
注冊申請人應說(shuō)明原始數據集和分析數據集所用編碼(如UTF-8���、EUC-CN等)���,以避免所遞交的數據集出現亂碼的情形�����。
3.注釋病例報告表
相對于空白CRF�,注釋CRF增加了注釋內容��,反映了數據庫中變量與CRF信息收集的對應關(guān)系�。例如�����,在性別空白處注釋變量名稱(chēng)sex����。利用注釋CRF�,審閱者可直觀(guān)地查閱各變量在CRF中的位置�����。CRF中可能收集了一些與臨床試驗結果分析無(wú)關(guān)的冗余數據���,這些數據可不包含在遞交的數據庫中��,但應在注釋CRF上明確標注為“不遞交”����,并闡明理由����。
4.其他說(shuō)明性文件
除以上說(shuō)明性文件外�����,鼓勵注冊申請人提交其他有利于審閱者快速了解臨床試驗數據庫內容和結構的說(shuō)明性文件(如概覽性文件�����、其他特殊情況說(shuō)明文件等)�����。
五��、遞交形式
原始數據庫����、分析數據庫�、說(shuō)明性文件和程序代碼分別放置于四個(gè)文件夾中�。
原始數據庫和分析數據庫建議采用XPT[1]數據傳輸格式遞交����,建議全部原始數據集形成一個(gè)XPT文件�����,全部分析數據集形成一個(gè)XPT文件�����。建議采用XPT第5版本(簡(jiǎn)稱(chēng)XPT V5)或以上版本作為數據遞交格式�。
數據說(shuō)明文件可采用PDF���、Word�����、Excel等文件格式�,其中變量詞典建議采用Excel文件��,注釋病例報告表建議采用PDF文件��。
程序代碼建議采用TXT文件格式����。
六���、起草單位
國家藥品監督管理局醫療器械技術(shù)審評中心��。