2019年4月18日�,為加強醫療器械產(chǎn)品注冊工作的監督和指導����,進(jìn)一步提高注冊審查質(zhì)量�,國家藥品監督管理局組織制定了《醫療器械動(dòng)物實(shí)驗研究技術(shù)審查指導原則 第一部分:決策原則》��。這是開(kāi)展動(dòng)物實(shí)驗判定路徑依據����,具有里程碑的意義��。這是國家藥監部門(mén)首次發(fā)布關(guān)于動(dòng)物實(shí)驗的官方文件�,結束了醫療器械動(dòng)物實(shí)驗長(cháng)期無(wú)規可循的局面�。
引言:2019年4月18日���,國家藥監局發(fā)布《關(guān)于發(fā)布醫療器械動(dòng)物實(shí)驗研究和腹腔內置疝修補補片動(dòng)物實(shí)驗2項技術(shù)審查指導原則的通告(2019年 第18號)》�,如下:
醫療器械動(dòng)物實(shí)驗研究技術(shù)審查指導原則第一部分:決策原則
一�����、前言
醫療器械安全性和有效性評價(jià)研究應采用科學(xué)�、合理的評價(jià)方法���,其中動(dòng)物實(shí)驗是重要手段之一�����,其屬于產(chǎn)品設計開(kāi)發(fā)中的重要研究��,可為產(chǎn)品設計定型提供相應的證據支持���;若需開(kāi)展臨床試驗��,可為醫療器械能否用于人體研究提供支持����,降低臨床試驗受試者及使用者的風(fēng)險以及為臨床試驗設計提供參考��。
但并不是所有醫療器械均需要通過(guò)動(dòng)物實(shí)驗驗證產(chǎn)品安全性和有效性����。為了對開(kāi)展動(dòng)物實(shí)驗的必要性判定提供指導�����,特制訂本原則����。
本原則為醫療器械動(dòng)物實(shí)驗研究技術(shù)審查指導原則系列中的第一部分��,為判定是否開(kāi)展醫療器械動(dòng)物實(shí)驗的決策原則����,關(guān)于動(dòng)物實(shí)驗設計等其他方面的內容請參見(jiàn)其他部分指導原則�����。
本原則是供申請人和技術(shù)審評人員使用的技術(shù)指導性文件����,不涉及注冊審批等行政事項����,亦不作為法規強制執行�����,如有能夠滿(mǎn)足法規要求的其他方法����,也可以采用�,但應提供充分的研究資料和驗證資料��。應在遵循相關(guān)法規的前提下使用本原則�。
本原則是在現行法規和標準體系以及當前認知水平下制訂的����,隨著(zhù)法規和標準的不斷完善�����,以及科學(xué)技術(shù)的不斷發(fā)展����,本原則相關(guān)內容也將進(jìn)行適時(shí)地調整�����。
二���、適用范圍
本原則適用于決策醫療器械是否需在活體動(dòng)物上進(jìn)行在體實(shí)驗�����,不包括在非活體動(dòng)物�、離體組織或器官上進(jìn)行的研究���。
以下情況可參考本原則:
(一)醫療器械申請人在設計開(kāi)發(fā)階段確定是否需要開(kāi)展動(dòng)物實(shí)驗時(shí)�����;
(二)醫療器械監管機構在技術(shù)審評環(huán)節評價(jià)開(kāi)展動(dòng)物實(shí)驗的必要性時(shí)�。
本原則不替代GB/T 16886系列標準等醫療器械生物學(xué)評價(jià)相關(guān)的技術(shù)文件���。如通過(guò)動(dòng)物實(shí)驗方式評價(jià)醫療器械的生物相容性��,亦應符合GB/T 16886系列標準等生物學(xué)評價(jià)相關(guān)技術(shù)文件��。
如有針對特定產(chǎn)品的指導原則發(fā)布��,則遵循相應產(chǎn)品的指導原則��。
本原則不適用于按照醫療器械管理的體外診斷試劑�����。
醫療器械臨床試驗倫理審查時(shí)����,可參考本原則中適用部分以評估臨床前動(dòng)物實(shí)驗的必要性�����。
三�����、基本決策原則
在醫療器械設計開(kāi)發(fā)階段���,決策是否開(kāi)展動(dòng)物實(shí)驗時(shí)�,建議考慮動(dòng)物福利倫理原則及風(fēng)險管理原則���。
(一)動(dòng)物福利倫理原則
申請人需遵循動(dòng)物實(shí)驗的“替代(Replacement)���、減少(Reduction)和優(yōu)化(Refinement)”原則����,即3R原則���。
申請人在決策是否開(kāi)展動(dòng)物實(shí)驗前���,需要特別考慮動(dòng)物福利倫理�,充分開(kāi)展實(shí)驗室研究�����,不宜采用動(dòng)物實(shí)驗替代實(shí)驗室研究���。
若有經(jīng)過(guò)確認/驗證的非活體研究��、計算機模擬等方法����,則優(yōu)先采用上述方法以替代動(dòng)物實(shí)驗�����。
申請人宜充分利用已有的信息獲取產(chǎn)品安全性��、有效性和可行性的相關(guān)證據��,如可利用已有的同類(lèi)產(chǎn)品動(dòng)物實(shí)驗數據或通過(guò)與市售同類(lèi)產(chǎn)品進(jìn)行性能比對等方式驗證產(chǎn)品的安全性����、有效性和可行性���。若相關(guān)證據充分����,可免于動(dòng)物實(shí)驗�。
(二)風(fēng)險管理原則
申請人在醫療器械設計開(kāi)發(fā)時(shí)應進(jìn)行充分的風(fēng)險管理活動(dòng)�。風(fēng)險控制作為風(fēng)險管理的重要部分����,是將風(fēng)險降低并維持在規定水平的過(guò)程���。實(shí)施每一項風(fēng)險控制措施后應對其有效性予以驗證(其中包括確認活動(dòng))��。實(shí)驗室研究或動(dòng)物實(shí)驗等均是驗證風(fēng)險控制措施有效性的手段��,申請人宜盡可能地通過(guò)前期研究(如實(shí)驗室研究等)對已識別風(fēng)險的控制措施有效性進(jìn)行驗證����,只有在實(shí)驗室研究不足時(shí)�����,才考慮通過(guò)動(dòng)物實(shí)驗開(kāi)展進(jìn)一步驗證���。動(dòng)物實(shí)驗資料可作為風(fēng)險/受益分析時(shí)的支持性資料�。
如需通過(guò)動(dòng)物實(shí)驗進(jìn)行風(fēng)險控制措施有效性的驗證�,則結合動(dòng)物實(shí)驗目的�����,一般從可行性��、有效性�����、安全性三方面進(jìn)行考慮:
1. 可行性
可行性研究是指產(chǎn)品設計開(kāi)發(fā)階段進(jìn)行的����,對產(chǎn)品工作原理��、作用機理�����、設計��、可操作性�、功能性��、安全性等方面進(jìn)行確認/驗證����,或識別新的非預期風(fēng)險的研究�,如生物可吸收支架平臺材料的篩選����、經(jīng)導管瓣膜置換裝置的設計可行性�����、迭代設計更新的驗證等���。
2. 有效性
盡管動(dòng)物與人體之間��,在部分醫療器械的有效性方面可能存在一定差異�,但設計合理的動(dòng)物實(shí)驗可支持產(chǎn)品的有效性(包括性能和操作)�,如可吸收防粘連醫療器械的防粘連性能評價(jià)��,組織修復材料引導組織重建的有效性評價(jià)��,多孔涂層關(guān)節類(lèi)產(chǎn)品或3D打印多孔結構產(chǎn)品的骨結合效果評價(jià)等����。
3. 安全性
申請人采取風(fēng)險控制措施后�,部分產(chǎn)品安全性可適當采用動(dòng)物實(shí)驗研究進(jìn)行評價(jià)�,如含藥醫療器械中藥物安全性范圍研究�����,通過(guò)組織病理學(xué)等方式的毒理學(xué)評價(jià)����、產(chǎn)品對生物體的損傷評價(jià)����,動(dòng)物源性材料的抗鈣化性能��,外科血管閉合設備的血管熱損傷研究���,防粘連器械與組織粘連相關(guān)并發(fā)癥的評價(jià)等��。
實(shí)驗目的有時(shí)是不能?chē)栏駝澐纸缦薜?����,因此一項?dòng)物實(shí)驗可能同時(shí)對產(chǎn)品的可行性����、有效性�、安全性進(jìn)行評價(jià)����。
若產(chǎn)品采用新的作用機理�、工作原理��、設計�����、主要材料/配方���、應用方法(如手術(shù)操作)����、預期用途���、增加新的適用范圍�����、改進(jìn)某方面性能等��,申請人應針對產(chǎn)品創(chuàng )新點(diǎn)相關(guān)風(fēng)險進(jìn)行評估�,并考慮通過(guò)動(dòng)物實(shí)驗對風(fēng)險控制措施的有效性進(jìn)行驗證���。
申請人可參考以下決策流程圖進(jìn)行是否開(kāi)展動(dòng)物實(shí)驗的決策�。
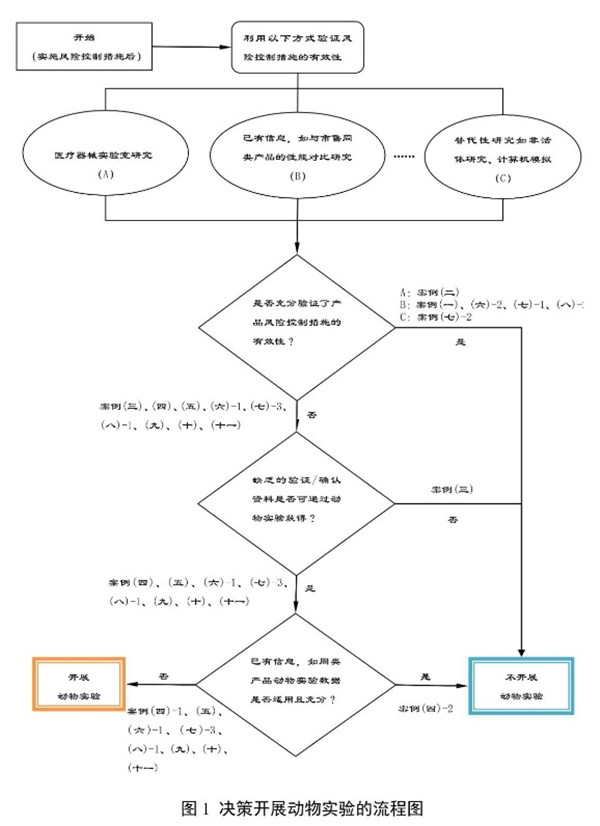
四�����、是否開(kāi)展動(dòng)物實(shí)驗的決策案例
附頁(yè)列出了部分可能需要開(kāi)展動(dòng)物實(shí)驗的產(chǎn)品示例��,需要注意的是�����,在不同的具體情形下����,根據決策原則對于同樣的產(chǎn)品可能將得出不同的判定結果�����;另外�����,對于表中未列的醫療器械產(chǎn)品���,在某些具體情形下也可能需要開(kāi)展動(dòng)物實(shí)驗���。建議申請人根據產(chǎn)品實(shí)際情況參照決策流程圖予以判定��。
為便于理解決策原則���,本章節列舉了以下實(shí)際案例�����。相關(guān)案例僅針對特定產(chǎn)品在具體情形下的決策判定���,例如同一申請人在前代植入式心臟起搏器基礎上對產(chǎn)品功能的改進(jìn)或更新��,再例如采用新材料制造的腸道吻合器等����。
(一)多孔涂層生物型髖關(guān)節假體
多孔涂層生物型髖關(guān)節假體的主要風(fēng)險包括產(chǎn)品骨結合效果欠佳或涂層剝落造成的假體固定失敗等���,通過(guò)動(dòng)物實(shí)驗可評價(jià)涂層的骨結合效果�。如果通過(guò)涂層的成分表征��、形貌及體視學(xué)數據(厚度���、孔隙率��、孔隙尺度等)��、涂層機械性能評價(jià)(涂層與基體結合強度等)�����、涂層穩定性及耐腐蝕性能評價(jià)�����、生物相容性評價(jià)等研究證明其與已上市同類(lèi)產(chǎn)品的涂層具有等同性��,則無(wú)需通過(guò)動(dòng)物實(shí)驗來(lái)評估多孔涂層的骨結合效果和涂層的穩定性���。
(二)心電圖機
心電圖機的主要風(fēng)險之一是工作數據的不準確性�,包括心電圖自動(dòng)測量的不準確性和心電圖自動(dòng)診斷的不準確性�����??蛇M(jìn)行實(shí)驗室研究�,通過(guò)心電圖標準數據庫來(lái)驗證心電圖自動(dòng)測量的準確性���,可通過(guò)形態(tài)診斷用心電圖數據庫和節律診斷用心電圖數據庫來(lái)確認公開(kāi)形態(tài)解釋的準確性和公開(kāi)節律診斷的準確性��,無(wú)需開(kāi)展動(dòng)物實(shí)驗���。
(三)注射用交聯(lián)透明質(zhì)酸鈉凝膠
交聯(lián)透明質(zhì)酸鈉凝膠可用于面部注射以糾正鼻唇溝皺紋��,糾正效果一般可達到6個(gè)月����。鑒于通過(guò)動(dòng)物實(shí)驗無(wú)法考察人體面部皺紋的改善程度�����,故一般不采用動(dòng)物實(shí)驗數據支持該類(lèi)產(chǎn)品的有效性���,建議在人體臨床評價(jià)資料中關(guān)注產(chǎn)品注射6個(gè)月時(shí)的鼻唇溝皺紋嚴重程度分級(如WSRS)較術(shù)前的改善程度等療效評價(jià)指標��。
(四)可吸收生物疝修補補片
本案例提及的可吸收生物疝修補補片用于修復腹壁疝及腹壁缺損�����,一般具有類(lèi)似細胞外基質(zhì)的微觀(guān)結構���。產(chǎn)品植入人體后����,宿主細胞在材料中生長(cháng)����,最終重塑出的腹壁組織對缺損進(jìn)行修補�。
1. 該類(lèi)產(chǎn)品最主要的風(fēng)險之一在于疝或腹壁缺損的復發(fā)�����,宜采取一系列風(fēng)險控制措施確保產(chǎn)品組織重建的有效性�����,以降低疝復發(fā)的風(fēng)險�。對于該類(lèi)產(chǎn)品�,僅僅依靠常規的實(shí)驗室研究并不能驗證疝復發(fā)風(fēng)險相關(guān)控制措施的有效性��,宜考慮使用組織病理學(xué)等動(dòng)物實(shí)驗數據驗證組織重建效果���。
2. 申請人在開(kāi)展動(dòng)物實(shí)驗前可收集已有同類(lèi)產(chǎn)品的動(dòng)物實(shí)驗資料或文獻數據�,并分析這些數據能否用于支持申報產(chǎn)品組織重建效果的評價(jià)����,如現有資料充分則無(wú)需開(kāi)展動(dòng)物實(shí)驗��。
(五)體外除顫產(chǎn)品
體外除顫產(chǎn)品供不同的使用者和操作者在不同的預期使用環(huán)境下進(jìn)行體外電復律治療��。
對于該類(lèi)產(chǎn)品��,常規的實(shí)驗室研究并不能驗證體外電復律技術(shù)風(fēng)險相關(guān)控制措施的有效性�����,因此宜使用活體動(dòng)物開(kāi)展實(shí)驗獲得除顫研究數據進(jìn)行驗證�����。
(六)超聲軟組織切割止血系統
超聲軟組織切割止血系統用于軟組織切割和血管閉合產(chǎn)品通過(guò)摩擦產(chǎn)生的熱量導致組織凝固后被切開(kāi)�、封閉血管(本例子不包含3mm以上血管的切割和閉合功能的特殊要求)��。
1. 該產(chǎn)品主要風(fēng)險包括產(chǎn)品設計不合理等原因可能造成的血管切割閉合不充分和組織熱損傷等�����。僅依靠實(shí)驗室研究無(wú)法充分驗證這些風(fēng)險的控制措施是否有效,需要通過(guò)急性動(dòng)物實(shí)驗觀(guān)察產(chǎn)品的即刻的血管切割閉合情況和組織熱損傷情況�����,需要通過(guò)慢性動(dòng)物實(shí)驗觀(guān)察熱損傷愈合情況和繼發(fā)出血情況�,進(jìn)而驗證風(fēng)險控制措施的有效性�����。
2. 若申請的產(chǎn)品包含多個(gè)類(lèi)似設計的刀頭�����,可在開(kāi)展動(dòng)物試驗前通過(guò)體外爆破壓力實(shí)驗篩選出性能最差的刀頭開(kāi)展動(dòng)物實(shí)驗���,以起到減免部分動(dòng)物實(shí)驗的目的���。對于新增與已有刀頭相似(設計類(lèi)似���、性能相近)的刀頭��,可使用體外爆破壓力實(shí)驗結果證明其與相似刀頭的等同性����,不再開(kāi)展動(dòng)物實(shí)驗���。
(七)植入式心臟起搏器
1. 植入式心臟起搏器屬于高風(fēng)險植入器械��,開(kāi)展動(dòng)物實(shí)驗可以為產(chǎn)品設計定型提供相應的證據支持����。若同一申請人在前代產(chǎn)品基礎上進(jìn)行植入式心臟起搏器的改進(jìn)或更新����,對于前代產(chǎn)品已驗證的內容無(wú)需開(kāi)展動(dòng)物實(shí)驗�,必要時(shí)申請人僅針對改進(jìn)或更新部分開(kāi)展相應的動(dòng)物實(shí)驗�。
2. 患者在植入心臟起搏器后一般不能進(jìn)行核磁共振檢查(MRI)����,如果申請人設計開(kāi)發(fā)了MRI兼容的植入式心臟起搏器�,需要評估MRI環(huán)境對產(chǎn)品安全性及有效性帶來(lái)的影響��,進(jìn)行MRI兼容性相關(guān)研究�。MRI兼容性研究通常需要應用動(dòng)物進(jìn)行計算機建模驗證MRI兼容的安全性與有效性�,當驗證過(guò)計算機建模的準確性后�����,對于同一申請人其他植入式心臟起搏器產(chǎn)品的MRI兼容性研究����,可以不再重復進(jìn)行動(dòng)物實(shí)驗���。
3. 無(wú)導線(xiàn)起搏器與傳統的植入式心臟起搏器相比�����,采用了新的結構設計�����、手術(shù)操作方法�,不需要植入傳統的植入式心臟電極導線(xiàn)�,申請人宜針對創(chuàng )新點(diǎn)相關(guān)風(fēng)險進(jìn)行評估���,并對風(fēng)險控制措施有效性進(jìn)行驗證或確認��,申請人宜對無(wú)導線(xiàn)起搏器開(kāi)展動(dòng)物試驗����,驗證產(chǎn)品安全性���、有效性及可行性����。
(八)藥物洗脫支架
1. 盡管藥物洗脫支架產(chǎn)品所含藥物如紫杉醇���、雷帕霉素已作為藥品具有較長(cháng)的臨床應用歷史�����,但在器械中應用與其單獨作為藥品應用時(shí)具有較大差異�,例如藥物洗脫支架植入后�����,靶血管壁中的局部組織藥物濃度會(huì )遠遠高于藥品系統使用后的血藥濃度��,單純作為藥品使用的藥代及毒理學(xué)研究資料并不足以支持其安全性����,宜進(jìn)一步通過(guò)動(dòng)物實(shí)驗開(kāi)展靶血管���、遠端心肌等局部組織的毒理學(xué)安全性研究����,獲取必要的組織病理學(xué)數據等���。對于兩個(gè)含有相同藥物的藥物洗脫支架��,若支架藥物載體材料不同�����,臨床應用時(shí)同樣存在較大差異����,例如藥物成分從不同載體材料中釋放�����、吸收的速率不同���,宜通過(guò)動(dòng)物實(shí)驗研究結合已有的文獻數據資料來(lái)確認藥物劑量密度及安全范圍����。
2. 對于涂有可降解涂層的藥物洗脫支架產(chǎn)品��,其降解性能是載體聚合物材料篩選中一項重要因素�。通過(guò)動(dòng)物實(shí)驗在體研究藥物洗脫支架涂層的降解性能十分必要�����,但如果載體聚合物(例如聚乳酸-羥基乙酸共聚物�����,PLGA)的降解性能���,可通過(guò)同類(lèi)產(chǎn)品信息����、文獻數據信息�、材料數據庫信息����、監管機構備案信息等獲得支持��,申請人無(wú)需對申報產(chǎn)品重新開(kāi)展降解性能的動(dòng)物實(shí)驗�。
(九)骨內固定用可降解金屬螺釘
骨內固定用可降解金屬螺釘�,該類(lèi)產(chǎn)品在骨愈合初期提供初始的穩定固定�����,待骨愈合后逐漸降解����,避免二次手術(shù)取出�。
該類(lèi)產(chǎn)品主要風(fēng)險包括降解周期與骨愈合周期不匹配造成內固定過(guò)早失效�����,以及降解產(chǎn)物對機體組織和器官帶來(lái)的安全性問(wèn)題等����。對于該類(lèi)產(chǎn)品�,僅僅依靠常規的實(shí)驗室研究并不能驗證失效風(fēng)險相關(guān)控制措施的有效性�,需要通過(guò)適宜的動(dòng)物模型的相應部位制備骨折或骨缺損模型����,評價(jià)可降解金屬產(chǎn)品在適宜的動(dòng)物體內的降解性能和產(chǎn)品的安全性及有效性�。具體試驗項目可包含X光評價(jià)��、血液中元素分析�、組織病理分析��、micro-CT分析�����、植入生物力學(xué)評價(jià)���、周?chē)墙M織分析等�����。
(十)吻合器
吻合器主要用于組織/臟器的切除���、閉合��。
1. 用于實(shí)質(zhì)臟器或血管切割/吻合的吻合器類(lèi)產(chǎn)品�,因常規的實(shí)驗室研究并不能充分驗證吻合器用于人體的操作性能和吻合性能����,宜開(kāi)展動(dòng)物實(shí)驗��。
2. 對于采用了新材料的腸道或皮膚吻合器類(lèi)產(chǎn)品���,若產(chǎn)品性能�、吻合釘材質(zhì)等與已上市產(chǎn)品存在差異性��,僅依靠常規的實(shí)驗室研究和現有數據不足以評價(jià)產(chǎn)品安全性和有效性��,宜開(kāi)展動(dòng)物實(shí)驗��。另外����,通過(guò)動(dòng)物實(shí)驗可確定產(chǎn)品臨床相關(guān)參數(如組織厚度等)����,預測產(chǎn)品在人體中使用時(shí)可能出現的安全性問(wèn)題��。
(十一)可吸收外科防粘連產(chǎn)品
對于可吸收外科防粘連產(chǎn)品��,應實(shí)現產(chǎn)品預期的防粘連功能�����。該功能宜在適當的活體動(dòng)物模型上進(jìn)行研究���。動(dòng)物實(shí)驗中宜盡可能地體現手術(shù)方法�����、特定手術(shù)部位�、粘連的類(lèi)型��、粘連的評價(jià)方式����,以及擬在臨床應用時(shí)的產(chǎn)品使用方法�,并觀(guān)察產(chǎn)品是否能有效降低粘連的發(fā)生率�����、廣泛程度及嚴重程度等����。另外����,通過(guò)動(dòng)物實(shí)驗也可以更好地為臨床研究方案設計提供參考����。
五��、參考資料
[1] General Considerations for AnimalStudies for Medical Devices (Draft Guidance)
[2] EFS Guidance: Investigational Device Exemptions (IDEs)for EarlyFeasibility Medical Device Clinical studies, Including Certain First in Human (FIH)Studies
[3] Recommended Content and Formatof Test Reports for Complete Non-Clinical Bench Performance Testing inPremarket Submissions (Draft Guidance)
[4]《超聲軟組織切割止血系統技術(shù)審查指導原則》(國家食品藥品監督管理總局通告2018年第37號)
[5]《腔鏡用吻合器產(chǎn)品注冊技術(shù)審查指導原則》(國家食品藥品監督管理總局通告2017年第44號)
[6]《腹腔��、盆腔外科手術(shù)用可吸收防粘連產(chǎn)品注冊技術(shù)審查指導原則》(國家食品藥品監督管理總局通告2016年第7號)
[7]《冠狀動(dòng)脈藥物洗脫支架臨床前研究指導原則》(國家藥品監督管理局通告2018年第21號)
[8]《體外除顫產(chǎn)品注冊技術(shù)指導原則》(國家食品藥品監督管理總局通告2017年第6號)
[9]《腹腔內置疝修補補片動(dòng)物實(shí)驗技術(shù)審查指導原則》
[10]《鈣磷/硅類(lèi)骨填充材料注冊技術(shù)審查指導原則》(國家食品藥品監督管理總局通告2017年第14號)
[11]《無(wú)源植入性醫療器械臨床試驗審批技術(shù)審查指導原則》(國家藥品監督管理局通告2018年第40號)
[12]YY/T 0316-2016《醫療器械風(fēng)險管理對醫療器械的應用》
[13]ISO 14971:2007 Medicaldevices—Application of risk management to medical devices
[14]“Non-AnimalApproaches - The Way Forward”, European Commission Scientific Conferencesummary report, Mark Cronin, March 2017
[15] Directive 2010/63/EU of TheEuropean Parliament And of The Council on the protection of animals used forscientific purposes
六��、編寫(xiě)單位:
本指導原則由國家藥品監督管理局醫療器械技術(shù)審評中心編寫(xiě)并負責解釋���。
標簽:動(dòng)物實(shí)驗 醫療器械注冊 臨床試驗