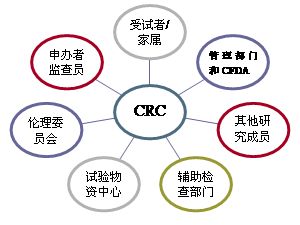
CRC團隊在研究中心協(xié)助臨床試驗機構進(jìn)行現場(chǎng)管理和具體操作的非醫學(xué)專(zhuān)業(yè)服務(wù)�,致力于通過(guò)提供臨床試驗相關(guān)的專(zhuān)業(yè)服務(wù)���,協(xié)助研究者和研究機構承擔在臨床試驗中非醫生判斷類(lèi)的事務(wù)性工作���,提高臨床試驗質(zhì)量和進(jìn)度�,推動(dòng)臨床試驗規范化進(jìn)程����。
一����、證標客CRC服務(wù)簡(jiǎn)介
CRC團隊在研究中心協(xié)助臨床試驗機構進(jìn)行現場(chǎng)管理和具體操作的非醫學(xué)專(zhuān)業(yè)服務(wù)�����,致力于通過(guò)提供臨床試驗相關(guān)的專(zhuān)業(yè)服務(wù)�,協(xié)助研究者和研究機構承擔在臨床試驗中非醫生判斷類(lèi)的事務(wù)性工作�,提高臨床試驗質(zhì)量和進(jìn)度�����,推動(dòng)臨床試驗規范化進(jìn)程�。
證標客的CRC團隊已經(jīng)在中國多個(gè)重要城市設有臨床研究協(xié)調員(Clinical Research Coordinator, CRC)服務(wù)網(wǎng)點(diǎn)���,截止到2018年6月�,已經(jīng)擁有30多人的專(zhuān)業(yè)化團隊����,建立了國際標準的操作規程(SOPs)�。團隊人員以護理���、醫學(xué)�����、藥學(xué)等專(zhuān)業(yè)背景為主����,熟悉ICH-GCP和GCP�,經(jīng)過(guò)良好的SOP和其他技能培訓��,英語(yǔ)水平良好��,熟悉Inform, Datatrack, Medidata Rave等電子數據采集系統�����。
二����、服務(wù)范圍
2.1 為申辦方/CRO提供的服務(wù)
項目可行性調研
倫理遞交
研究者會(huì )議組織
受試者招募
研究中心信息收集
試驗預算管理
研究相關(guān)培訓
內部稽查
臨床試驗項目管理
試驗物資和試驗文件管理
2.2 為研究機構/研究者提供的服務(wù)
臨床試驗管理
專(zhuān)業(yè)臨床研究協(xié)調員(CRC)配備
研究文檔的管理
受試者招募與管理
研究物資管理
數據管理
倫理和機構的溝通
安全信息的管理
研究中心管理
研究中心SOP的建立和完善
機構認證輔導
研究者及其他參與人員的培訓
協(xié)助機構對在研項目的稽查
協(xié)助接受SFDA現場(chǎng)核查
費用協(xié)商
標簽:醫療器械臨床試驗�����、CRC服務(wù)費用�����、浙江SMO機構