醫療器械優(yōu)先審批程序
一�����、什么類(lèi)型的產(chǎn)品可以申請醫療器械優(yōu)先審批程序����?
1.診斷或者治療罕見(jiàn)病��、惡性腫瘤且具有明顯臨床優(yōu)勢���,診斷或者治療老年人特有和多發(fā)疾病且目前尚無(wú)有效診斷或者治療手段��,專(zhuān)用于兒童且具有明顯臨床優(yōu)勢�����,或者臨床急需且在我國尚無(wú)同品種產(chǎn)品獲準注冊的醫療器械�;
2.列入國家科技重大專(zhuān)項或者國家重點(diǎn)研發(fā)計劃的醫療器械��;
3.國家藥品監督管理局規定的其他可以適用優(yōu)先注冊程序的醫療器械���。
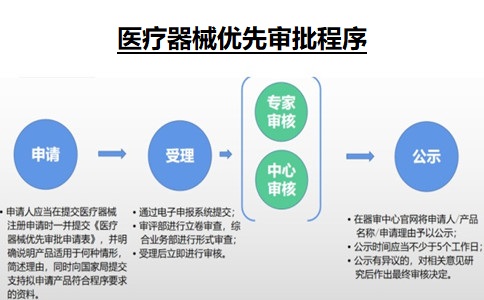
二���、如何申請醫療器械優(yōu)先審批程序�����?
申請適用優(yōu)先注冊程序的��,申請人應當在提出醫療器械注冊申請時(shí)�,向國家藥品監督管理局提出適用優(yōu)先注冊程序的申請����。屬于《醫療器械注冊與備案管理辦法》第七十三條第一項情形的�,由國家藥品監督管理局組織專(zhuān)家進(jìn)行審核����,符合的���,納入優(yōu)先注冊程序���;屬于《醫療器械注冊與備案管理辦法》第七十三條第二項情形的�,由國家局器械審評中心進(jìn)行審核�,符合的����,納入優(yōu)先注冊程序��;屬于《醫療器械注冊與備案管理辦法》第七十三條第三項情形的�����,由國家藥品監督管理局廣泛聽(tīng)取意見(jiàn)���,并組織專(zhuān)家論證后確定是否納入優(yōu)先注冊程序�����。
第七十五條 對納入優(yōu)先注冊程序的醫療器械注冊申請�����,國家藥品監督管理局優(yōu)先進(jìn)行審評審批����,省�、自治區���、直轄市藥品監督管理部門(mén)優(yōu)先安排醫療器械注冊質(zhì)量管理體系核查�。
國家局器械審評中心在對納入優(yōu)先注冊程序的醫療器械產(chǎn)品開(kāi)展技術(shù)審評過(guò)程中����,應當按照相關(guān)規定積極與申請人進(jìn)行溝通交流�����,必要時(shí)�����,可以安排專(zhuān)項交流���。