醫療器械臨床試驗是指:獲得醫療器械臨床試驗資格的醫療機構(以下稱(chēng)醫療機構)對申請注冊的醫療器械在正常使用條件下的安全性和有效性按照規定進(jìn)行試用或驗證的過(guò)程����。醫療器械臨床試驗的目的是評價(jià)受試產(chǎn)品是否具有預期的安全性和有效性 �。
隨著(zhù)新版GCP的發(fā)布�,醫療器械臨床試驗流程也發(fā)生了變化���。新版GCP要求���,醫療器械臨床試驗按照國家有關(guān)部門(mén)對醫療器械臨床試驗的有關(guān)規定�����,選擇臨床醫療機構進(jìn)行臨床試驗�,并對臨床試驗結果進(jìn)行跟蹤和分析�����,直至完成臨床試驗報告���。以下是醫療器械臨床試驗流程的大致流程����。
醫療器械臨床試驗準備:
一����、臨床試驗方案;
二�、研究者手冊或等效文件;
三�、知情同意書(shū)樣張和其他任何提供給受試者的書(shū)面材料;
四�、招募受試者和向其宣傳的程序;
五��、主要研究者簡(jiǎn)歷和/或其他證明其資格的文件;
六�、病例報告表樣張;
七��、給予受試者報酬或補償的文件;
八����、倫理委員會(huì )履行職責所需要的其他文件;
九����、試驗用醫療器械�。
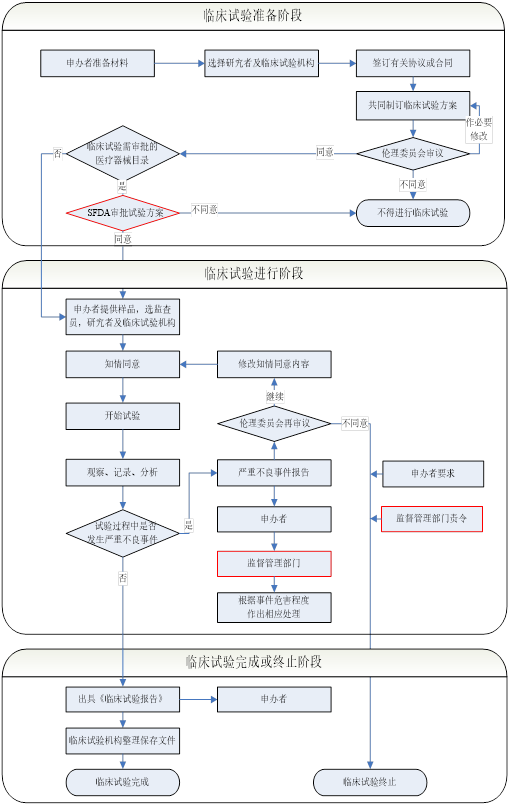
醫療器械臨床試驗步驟:
步驟1:
申辦者根據自身的產(chǎn)品的特點(diǎn)���、預期用途���、適應癥�����、適用范圍�����、選擇臨床試驗中心��。至少需要確定兩家臨床上實(shí)驗中心���,并與醫院負責承接臨床試驗的負責人洽談是否可以承接臨床試驗的項目����。
步驟2:
如果可以承接的話(huà)���,就確定放在哪個(gè)科室進(jìn)行�����,其主要研究者的名字并收集齊研究者的主要履歷及簽名的樣張
步驟3:
對臨床方案和CRF表格的設計���,并召開(kāi)臨床方案的討論會(huì )議
步驟4:
準備倫理委員會(huì )的材料�。一般包括: 一�、臨床試驗方案; 二�����、研究者手冊或等效文件; 三����、知情同意書(shū)樣張和其他任何提供給受試者的書(shū)面材料; 四��、招募受試者和向其宣傳的程序; 五�����、主要研究者簡(jiǎn)歷和/或其他證明其資格的文件; 六�、病例報告表樣張; 七����、給予受試者報酬或補償的文件; 八����、倫理委員會(huì )履行職責所需要的其他文件; 九�����、試驗用醫療器械�����。
步驟5:
如果倫理會(huì )通過(guò)的話(huà)�����,需要與倫理會(huì )簽訂臨床協(xié)議的項目書(shū)��。
步驟6:
召開(kāi)臨床試驗的啟動(dòng)會(huì )�����。
步驟7:
對臨床試驗的過(guò)程進(jìn)行監察和稽查����,并對臨床試驗的過(guò)程中的記錄和醫療器械的發(fā)放進(jìn)行監督和記錄�����。
步驟8:
在臨床試驗試驗的后期對臨床的數據統計和分析����,并對臨床報告的總結�。
步驟9:
得出臨床試驗的結論:臨床試驗的產(chǎn)品是安全�、有效的�?���;颊叱惺艿娘L(fēng)險小于其受益��。