摘要:繼生產(chǎn)���、流通���、使用環(huán)節的抽檢之后���,醫療器械臨床試驗抽檢已經(jīng)在全國各地開(kāi)展����。以下是2016年至今2018年總局三年內的醫療器械臨床抽檢公告進(jìn)行了總結����。

一���、硝煙彌漫的戰場(chǎng)
2016年�,CFDA抽取20個(gè)項目開(kāi)展臨床試驗現場(chǎng)檢查��,8個(gè)存在真實(shí)性問(wèn)題���。
2017年��,CFDA抽取19個(gè)項目開(kāi)展臨床試驗現場(chǎng)檢查��,3個(gè)存在真實(shí)性問(wèn)題��。
2018年�,截止目前���,CFDA抽取20個(gè)項目開(kāi)展臨床試驗現場(chǎng)檢查�,9個(gè)有合規性問(wèn)題���,未公布有真實(shí)性問(wèn)題(請注意第二批10個(gè)項目結果尚未公布����,但我司項目已傳佳績(jì))�����。
各省局臨床核查也已開(kāi)展多年�,如廣東�、北京��、上海���、江蘇���、廣西���、浙江���、湖南��、天津���、遼寧��、河南��、安徽�、四川����、山西……
不幸的是:在核查通告中��,我們不難發(fā)現IVD問(wèn)題較多��,是“重災區”�。
我們還發(fā)現:目前開(kāi)展的臨床試驗監督抽查不僅關(guān)注的是在注冊項目��,還包括備案后現處于試驗中的項目����。
由此可見(jiàn)�,監管部門(mén)對臨床核查有著(zhù)強大的決心���、恒心���、專(zhuān)心�����。
寫(xiě)到此��,心情沉重�����,小編覺(jué)得“質(zhì)量保證��,準時(shí)交付”不僅是我們給客戶(hù)��、公司的承諾�,更是我們部門(mén)給自己的“軍令狀”:
a)確保臨床進(jìn)度時(shí)��,同時(shí)也要做好質(zhì)量控制和質(zhì)量保證���;
b)法規要求絕不是“優(yōu)秀線(xiàn)”��,勉強算上“及格線(xiàn)”��;
c)臨床試驗的質(zhì)量不是操作出來(lái)的�,而是設計出來(lái)的�;
d)加強臨床試驗管理�,才能保證試驗規范��,才能使得產(chǎn)品安全性和有效性可信���,才能維護好受試者的權益��。
二����、臨床試驗質(zhì)量控制法規依據
《醫療器械監督管理條例》的決定 (國令第680號)
《體外診斷試劑注冊管理辦法》(局令第5號)
《醫療器械注冊管理辦法》(局令第4號)
《醫療器械臨床試驗質(zhì)量管理規范》(局令第 25號)
《體外診斷試劑臨床實(shí)驗指導原則》(2014年16號通告)
《體外診斷試劑臨床試驗指導原則(征求意見(jiàn)稿)》(2018年11月22日)
《醫療器械臨床試驗規定》(局令第5號)(廢止)
《總局關(guān)于開(kāi)展醫療器械臨床試驗監督抽查工作的通告》(2016年第98號)
《國家藥監局綜合司關(guān)于印發(fā)醫療器械臨床試驗檢查要點(diǎn)及判定原則的通知》(藥監綜械注〔2018〕45號)
三���、臨床試驗監督抽查內容
目前臨床監督抽查主要是圍繞臨床試驗的真實(shí)性和合規性開(kāi)展�����。依據 2018年11月28日發(fā)布《醫療器械臨床試驗檢查要點(diǎn)及判定原則》(藥監綜械注〔2018〕45號)�����,根據檢查發(fā)現的問(wèn)題����,檢查結果按以下原則判定�。
3.1 有以下情形之一的����,判定為存在真實(shí)性問(wèn)題:
(1)編造受試者信息��、主要試驗過(guò)程記錄���、研究數據�����、檢測數據等臨床試驗數據�,影響醫療器械安全性�����、有效性評價(jià)結果的����;
(2)臨床試驗數據�����,如入選排除標準���、主要療效指標����、重要的安全性指標等不能溯源的����;
(3)試驗用醫療器械不真實(shí)�,如以對照用醫療器械替代試驗用醫療器械����、以試驗用醫療器械替代對照用醫療器械����,以及以其他方式使用虛假試驗用醫療器械的��;
(4)瞞報與臨床試驗用醫療器械相關(guān)的嚴重不良事件和可能導至嚴重不良事件的醫療器械缺陷���、使用方案禁用的合并用藥或醫療器械的���;
(5)注冊申請的臨床試驗報告中數據與臨床試驗機構保存的臨床試驗報告中的數據不一致����,影響醫療器械安全性�����、有效性評價(jià)結果的�����;
(6)注冊申請的臨床試驗統計分析報告中數據與臨床試驗統計數據庫中數據或分中心臨床試驗小結中數據不一致���,影響醫療器械安全性����、有效性評價(jià)結果的��;
(7)其他故意破壞醫療器械臨床試驗數據真實(shí)性的情形�����。
3.2 未發(fā)現真實(shí)性問(wèn)題的�����,但臨床試驗過(guò)程不符合醫療器械臨床試驗相關(guān)規定要求的���,判定為存在合規性問(wèn)題�。
3.3 未發(fā)現上述問(wèn)題的���,判定為符合要求�����。
四�、監督抽查總結
下圖是2016~2018年臨床監督抽查公告中的常見(jiàn)問(wèn)題分析�。其中“核心文件”的整理是最令人頭疼的�,此外����,“物資管理”���、“試驗數據”也是臨床真實(shí)性核查中最常見(jiàn)的問(wèn)題��。
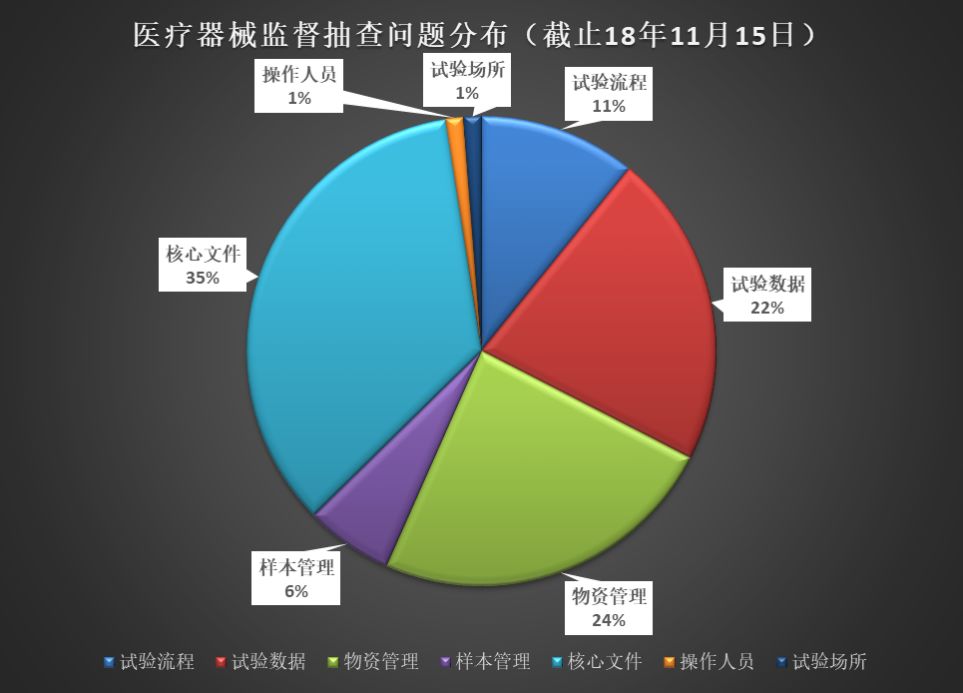
“核心文件”——藥監局是有發(fā)目錄清單的(總局關(guān)于發(fā)布《醫療器械臨床試驗倫理審查申請與審批表范本》等六個(gè)文件的通告(2016年第58號):附件6.醫療器械臨床試驗應當保存的基本文件目錄)�����。文件工作是最基本的工作�,實(shí)際檢查出來(lái)的情況確讓人堪憂(yōu)�����。如果連“文件工作”都做不好����,藥監局的老師們如何相信臨床試驗的合規性���、真實(shí)性呢���?
基于此���,也請大家延伸思考2個(gè)問(wèn)題:
a) 每一個(gè)臨床試驗參與者�,會(huì )不會(huì )是另一個(gè)臨床試驗的受試者呢����?
b) 每一個(gè)臨床試驗參與者�����,會(huì )不會(huì )又是另一個(gè)產(chǎn)品經(jīng)過(guò)臨床試驗并被批準上市的最終使用者呢��?
“物資管理”和“試驗數據”——均可以通過(guò)文件和記錄體現����?��!夺t療器械臨床試驗質(zhì)量管理規范(25號令)》要求如下:
第78條所述“臨床試驗結束時(shí)�����,研究者應當確保完成各項記錄�、報告�����。同時(shí)�����,研究者還應當確保收到的試驗用醫療器械與所使用的���、廢棄的或者返還的數量相符合���,確保剩余的試驗用醫療器械妥善處理并記錄存檔”�����;
第80條所述“在臨床試驗中�,研究者應當確保將任何觀(guān)察與發(fā)現均正確完整地予以記錄���,并認真填寫(xiě)病例報告表”�;
第82條所述“申辦者應當準確�、完整地記錄與臨床試驗相關(guān)的信息”�。
通告中顯示不少項目缺失研究產(chǎn)品“交接記錄”��、“運輸記錄”�����、“儲存條件”���、“分發(fā)記錄”�����、“使用記錄”��、“回收/銷(xiāo)毀記錄”��,甚至還有記錄顯示試驗用樣本“已經(jīng)超過(guò)有效期”�����,我們不禁要問(wèn)“真的有做過(guò)臨床試驗嗎�?”
另外����,同一個(gè)項目在不同臨床試驗機構被檢查出的問(wèn)題基本是一致的�。究其根本原因�,需要考慮下是否是——臨床試驗申辦方及其代表(如CRO)對于臨床試驗態(tài)度的問(wèn)題了——有些文件不是有就行了��,如果忽略了時(shí)間關(guān)系和邏輯順序����,那么低級錯誤就會(huì )頻繁發(fā)生���。
隨著(zhù)監管力度越嚴��,如果大家還是抱有僥幸心理并企圖蒙混過(guò)關(guān)����,總有一天會(huì )自食惡果���,因為“出來(lái)混終是要還的”����。
小編在工作中無(wú)意發(fā)現����,有些機構老師根據通告做了《申辦方與醫院“黑名單”》����,聲稱(chēng)不與他們合作�����。碰到這種中心�,小編認為還是應該好好珍惜����,當以自勉��,互相學(xué)習����,早日進(jìn)步為宜����。
五��、通告案例問(wèn)題歸納
5.1 臨床試驗機構方面
未經(jīng)審核同意在臨床試驗機構以外場(chǎng)所進(jìn)行試驗���。
5.2 臨床試驗中實(shí)施者/申請人的職責履行情況
有非臨床試驗機構人員參與試驗設備操作����。
5.3 臨床試驗的批準備案情況
(1) 研究者未全程參與臨床試驗方案的制定過(guò)程��;
(2) 臨床試驗方案修訂未經(jīng)醫院倫理委員會(huì )����、申辦方���、主要研究者批準����;
(3) 方案無(wú)主要研究者����、統計學(xué)負責人簽字或無(wú)機構蓋章�����;
(4) 方案無(wú)臨床試驗主管部門(mén)意見(jiàn)�、蓋章�����。
5.4 倫理審查方面
(1) 倫理委員會(huì )批準的知情同意書(shū)��、CRF內容與執行的知情同意書(shū)��、CRF內容不一致����;
(2) 需要快審資料���,未提供主審委員的快審審查意見(jiàn)��;
(3) 倫理批件未見(jiàn)倫理委員會(huì )會(huì )議簽到表�;
(4) 倫理批件未標明臨床試驗方案和知情同意書(shū)的版本號�����;
(5) 知情同意書(shū)中缺少風(fēng)險告知內容�����;
(6) 無(wú)合理理由家屬代簽知情同意書(shū)�。
5.5 臨床試驗準備情況
(1) 未按照試驗用醫療器械的預期用途進(jìn)行方案設計��;
(2) 臨床試驗方案編制不嚴謹�����,前后不一致或者相互矛盾�;
(3) 《醫療器械臨床試驗須知》中無(wú)受試產(chǎn)品的技術(shù)指標等����;
(4) 病例未按照統計學(xué)原理進(jìn)行選取�����,且抽查病例的干擾病例指標無(wú)法溯源��;
(5) 未根據臨床試驗方案制定標準操作規程����;
(6) 未提供臨床試驗質(zhì)控品交接和檢測記錄���;
(7) 未提供對照產(chǎn)品的相關(guān)資質(zhì)文件�;
(8) 多中心試驗中����,參比試劑不同�����;
(9) 臨床試驗記錄�����、表格��、文件等資料未簽署具體意見(jiàn)或未蓋章���。
5.6 臨床試驗實(shí)施情況
(1) 未嚴格按照制定的臨床試驗方案開(kāi)展試驗����;
(2) 受試者入組前未按方案要求完成全部檢測���;
(3) 未開(kāi)展預實(shí)驗;
(4) 監查方案可操作性不強�����,未能在監查中及時(shí)發(fā)現問(wèn)題���。
(5) 未記錄合并用藥���;
(6) 臨床試驗樣本的存儲條件與實(shí)際不一致���;
(7) 對比試劑的適用機型與試驗用儀器不符���。
5.7 臨床試驗數據管理
(1) 原始病歷中相關(guān)記錄不全�����;
(2) 臨床試驗相關(guān)圖像評估記錄不全���;
(3) 病例臨床試驗原始記錄未記錄修改原因和時(shí)間�����;
(4) 樣本無(wú)篩選記錄���;
(5) 項目培訓記錄不完全或缺失��;
(6) 監查記錄不完全或缺失��;
(7) 病例報告表記錄不符合要求���;
(8) 病例報告表表中數據與原始記錄不一致���;
(9) 臨床試驗檢測數據無(wú)操作者����、復核者簽字確認等��;
(10) 漏報不良事件���、嚴重不良事件��、器械缺陷等�����;
(11) 剔除數據無(wú)依據和說(shuō)明����;
(12) 未記錄受試產(chǎn)品的失效日期等���;
(13) 臨床試驗用設備使用記錄缺失�����。
5.8受試產(chǎn)品的管理
(1) 通過(guò)現場(chǎng)檢查和調取注冊申請資料還發(fā)現�,該注冊申請項目在開(kāi)展臨床試驗前未提交該產(chǎn)品的型式試驗報告����;
(2) 未提供受試產(chǎn)品���、對照產(chǎn)品的分發(fā)和回收記錄��;
(3) 儀器交接記錄未保留快遞單號�;
(4) 試驗用樣本試劑交付給臨床試驗機構時(shí)已經(jīng)超過(guò)有效期��。
5.9 臨床試驗用樣本的管理
(1) 樣本重復使用��,未提供相應說(shuō)明�;
(2) 樣本采集�����、儲存���、分發(fā)����、使用��、留樣��、銷(xiāo)毀記錄不完全或缺失�;
(3) 樣本類(lèi)型不符���、無(wú)法追溯�����。
5.10 申報資料的情況
(1) 倫理委員會(huì )保存的方案與注冊申報材料中的方案病例數和病例分配不一致��;
(2) 提交的注冊申請中的臨床試驗方案�����、報告與臨床試驗機構保存的臨床試驗方案���、報告簽章不一致�;
(3) 臨床試驗用產(chǎn)品與注冊申報資料的臨床試驗方案和試驗報告中的產(chǎn)品為不一致����;
(4) 部分臨床數據與現場(chǎng)提供的統計分析數據不一致等�����;
(5) 統計分析報告表未對剔除病例做出說(shuō)明等�����;
(6) 臨床機構保存的可溯源的隨訪(fǎng)例數與注冊申報資料的臨床試驗總結報告隨訪(fǎng)例數不一致���。
小結:限于篇幅問(wèn)題��,小編就先寫(xiě)到這了��。臨床試驗現場(chǎng)核查目前只是剛剛拉開(kāi)帷幕���,作為正在或即將踏上臨床試驗征途的法規工作者��,我們要“冬練三九�����,夏練三伏”��,穩扎穩打���,放眼全局��。在進(jìn)行臨床試驗時(shí)�����,我們要保證質(zhì)量�,不要一味的追求進(jìn)度而忽視質(zhì)量���,要遵循產(chǎn)品的自身特點(diǎn)和預期用途��,要遵循相關(guān)法律法規和相關(guān)的SOP要求����,否則必將前功盡棄����、玩火自焚�。
以上內容只是小編的幾點(diǎn)薄見(jiàn)����,如若存在錯誤的地方�����,歡迎批評指正��。