質(zhì)子治療作為新興的一種放射治療手段���,已經(jīng)越來(lái)越多的在國內外市場(chǎng)普及�。在我國按照第三類(lèi)醫療器械注冊產(chǎn)品管理���,產(chǎn)品上市前需要按要求完成醫療器械臨床試驗或同品種比對臨床評價(jià)��。一起來(lái)了解質(zhì)子治療系統臨床評價(jià)國內外現狀�����。
引言:質(zhì)子治療作為新興的一種放射治療手段�,已經(jīng)越來(lái)越多的在國內外市場(chǎng)普及��。在我國按照第三類(lèi)醫療器械注冊產(chǎn)品管理�,產(chǎn)品上市前需要按要求完成醫療器械臨床試驗或同品種比對臨床評價(jià)�。一起來(lái)了解質(zhì)子治療系統臨床評價(jià)國內外現狀���。
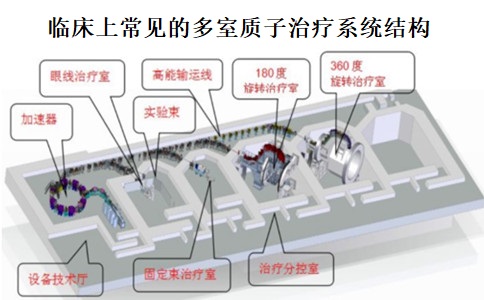
質(zhì)子治療作為新興的一種放射治療手段���,已經(jīng)越來(lái)越多的在國內外市場(chǎng)普及���。目前�,已有IBA���、Varian等多個(gè)廠(chǎng)家的多款質(zhì)子治療系統產(chǎn)品在美國���、歐盟和日本等市場(chǎng)上市�,2022年9月���,上海艾普強粒子設備有限公司生產(chǎn)的質(zhì)子治療系統是我國首臺獲批上市的國產(chǎn)質(zhì)子治療系統��,意味著(zhù)國產(chǎn)質(zhì)子治療設備實(shí)現“零的突破”���。通過(guò)研究質(zhì)子治療系統在國內外的上市要求�����,我中心對質(zhì)子治療系統的臨床評價(jià)要求形成了新的研究方向�。
一�、美國�、歐盟等發(fā)達國家對于質(zhì)子治療系統上市前臨床評價(jià)的情況
1.美國
質(zhì)子治療系統在美國的管理類(lèi)別是II類(lèi)��,器械通過(guò)510(k)路徑上市�����。510(k)路徑要求申報器械與比對器械在預期用途和技術(shù)特征兩方面進(jìn)行對比以論證兩者實(shí)質(zhì)性等同��,實(shí)質(zhì)性等同包括兩種情況:(1)申報器械與比對器械預期用途和技術(shù)特征完全相同�;(2)申報器械與比對器械預期用途相同�,技術(shù)特征存在差異���,差異不引起不同的安全有效性問(wèn)題���,且提供的信息(如恰當的科學(xué)數據)證明申報器械具有與比對器械同樣的安全有效性���。
2.歐盟
質(zhì)子治療系統在歐盟的管理類(lèi)別是IIb類(lèi)�����。歐盟器械的臨床評價(jià)貫穿于全生命周期��,要求申請人基于器械預期用途����,收集上市前臨床數據�����,制定上市后監測計劃�����,對器械臨床安全性和有效性進(jìn)行持續評價(jià)��。歐盟MDR規定對于植入器械和III類(lèi)器械除特殊情形下應開(kāi)展臨床試驗���,質(zhì)子治療系統不屬于需開(kāi)展臨床試驗的情形����。
二����、我國對于質(zhì)子治療系統開(kāi)展上市前臨床評價(jià)的情況
在我國���,質(zhì)子治療系統劃分為第三類(lèi)醫療器械��,國家藥品監督管理局發(fā)布了《質(zhì)子碳離子治療系統臨床評價(jià)技術(shù)審查指導原則》��,為質(zhì)子治療系統在境內上市的臨床評價(jià)要求提供了指導��。隨著(zhù)質(zhì)子治療技術(shù)的進(jìn)展�����,以及臨床使用經(jīng)驗的不斷積累�����,我國對于質(zhì)子治療系統的臨床療效的認識也在不斷加深����,對保障其安全有效的臨床評價(jià)要求也需要與時(shí)俱進(jìn)��,以符合科學(xué)監管的需要���。