引言:近日����,藥監總局發(fā)布2019年度醫療器械注冊工作報告���,報告中包括了哪些重要信息�?一起來(lái)了解����。

2019年度醫療器械注冊工作報告
2019年���,國家藥監局以習近平新時(shí)代中國特色社會(huì )主義思想為指導���,全面貫徹“四個(gè)最嚴”要求�,以保護和促進(jìn)公眾用械安全為使命����,持續深化醫療器械審評審批制度改革���,推動(dòng)監管科學(xué)研究�����,堅持風(fēng)險管理�����,強化責任落實(shí)���,推進(jìn)智慧監管��,著(zhù)力提升醫療器械注冊審評審批的質(zhì)量與效率���。
一�、醫療器械注冊工作情況
?��。ㄒ唬┽t療器械法規體系進(jìn)一步完善
1.積極推進(jìn)醫療器械監督管理條例修訂��。配合司法部開(kāi)展重點(diǎn)問(wèn)題實(shí)地調研并對條例進(jìn)一步修改完善���,同步啟動(dòng)配套規章����、規范性文件的制修訂���。
2.發(fā)布《定制式醫療器械監督管理規定(試行)》(2019年第53號公告)�。明確定制式醫療器械的定義�、備案��、設計�����、加工����、使用��、監督管理等方面要求�����,進(jìn)一步鼓勵定制式醫療器械的創(chuàng )新研發(fā)�,滿(mǎn)足臨床罕見(jiàn)個(gè)性化需求���。
3.持續推進(jìn)醫療器械技術(shù)審查指導原則制修訂��。發(fā)布《醫療器械附條件批準上市指導原則》等57項醫療器械技術(shù)審查指導原則�����,統一審查尺度�����,提升各級藥品監管部門(mén)審查水平���。
?�。ǘ┽t療器械審評審批制度改革持續深入
1.優(yōu)化臨床試驗審批��。發(fā)布《關(guān)于調整醫療器械臨床試驗審批程序的公告》(2019年第26號公告)��,進(jìn)一步優(yōu)化臨床試驗審批程序���,由“明示”許可調整為“默示”許可�����。
2.繼續擴大免于進(jìn)行臨床試驗醫療器械目錄�。發(fā)布《關(guān)于公布新增和修訂的免于進(jìn)行臨床試驗醫療器械目錄的通告》(2019年第91號公告)�,新增148項醫療器械產(chǎn)品和23項體外診斷試劑產(chǎn)品免于進(jìn)行臨床試驗�,對48項醫療器械產(chǎn)品和4項體外診斷試劑產(chǎn)品名稱(chēng)和描述進(jìn)行了修訂�����。目前免于進(jìn)行臨床試驗醫療器械目錄包含1003項�����,體外診斷試劑目錄包含416項����,合計達到1419項����。
3.持續做好創(chuàng )新醫療器械審批工作�����。2019年共有36個(gè)創(chuàng )新產(chǎn)品和12個(gè)優(yōu)先審批產(chǎn)品進(jìn)入“綠色通道”�����。批準正電子發(fā)射斷層掃描及磁共振成像系統等19個(gè)創(chuàng )新醫療器械����,中空纖維膜血液透析濾過(guò)器等10項優(yōu)先產(chǎn)品上市��,促進(jìn)醫療器械產(chǎn)業(yè)創(chuàng )新發(fā)展���,滿(mǎn)足人民群眾使用高水平醫療器械需要���。
4.擴大醫療器械注冊人制度試點(diǎn)�����。印發(fā)《國家藥監局關(guān)于擴大醫療器械注冊人制度試點(diǎn)工作的通知》��,將醫療器械注冊人制度試點(diǎn)推至北京��、江蘇�����、浙江等21個(gè)省��、自治區和直轄市���。2019年共有22家企業(yè)的93個(gè)產(chǎn)品按照注冊人制度試點(diǎn)獲批�����,其中包括跨省委托生產(chǎn)和第三類(lèi)醫療器械通過(guò)注冊人制度委托生產(chǎn)等不同情況���。進(jìn)一步釋放醫療器械注冊人制度紅利��,鼓勵醫療器械創(chuàng )新�,落實(shí)主體責任�,為全面實(shí)施醫療器械注冊人制度提供重要支撐�。
?。ㄈ┽t療器械基礎工作不斷夯實(shí)
1.醫療器械標準體系進(jìn)一步健全��。2019年��,國家藥監局下達108項標準制修訂項目����,其中國家標準15項��、行業(yè)標準93項�。發(fā)布行業(yè)標準72項�����。截止2019年底���,醫療器械現行有效標準共1671項����,其中國家標準220項���,行業(yè)標準1451項��,我國標準與國際標準一致性程度達到90.4%�����。
2.分類(lèi)和命名工作持續完善���。優(yōu)化藥械組合產(chǎn)品屬性界定工作�,發(fā)布《關(guān)于調整藥械組合產(chǎn)品屬性界定有關(guān)事項的通告》����。制定分類(lèi)目錄動(dòng)態(tài)調整工作程序�。分3批公布1073項分類(lèi)界定結果�,指導各方精準分類(lèi)��。發(fā)布《醫療器械通用名稱(chēng)命名指導原則》��,進(jìn)一步規范醫療器械通用名稱(chēng)��。
?��。ㄋ模┽t療器械智慧監管初見(jiàn)成效
1.推進(jìn)注冊電子申報�����。印發(fā)《關(guān)于實(shí)施醫療器械注冊電子申報的公告》��,建立注冊電子申報信息系統(eRPS)�,實(shí)現注冊申報網(wǎng)上辦理����。2019年�,共有7512項注冊申請通過(guò)線(xiàn)上提交����。
2.開(kāi)展立卷審查���。實(shí)現審評項目智能分配��,簡(jiǎn)單項目和復雜項目分級審評�,首次注冊�����、復雜變更和臨床試驗審批立卷審查�,以臨床為導向的分段審評制度和復雜項目管理人制度逐步建立���。
3.實(shí)施醫療器械唯一標識�。印發(fā)《醫療器械唯一標識系統規則》和相關(guān)標準�����,完成醫療器械唯一標識數據庫一期工程建設�����,賦予產(chǎn)品“電子身份證”���。強化源頭賦碼����,探索從源頭生產(chǎn)到臨床使用全鏈條聯(lián)動(dòng)�����。會(huì )同國家衛生健康委印發(fā)《醫療器械唯一標識系統試點(diǎn)工作方案》����,聯(lián)合開(kāi)展試點(diǎn)��。發(fā)布第一批醫療器械唯一標識工作有關(guān)事項的通告�����,明確品種范圍���、進(jìn)度安排和工作要求����,分步推動(dòng)醫療器械唯一標識工作有序開(kāi)展�����。
?��。ㄎ澹┡R床試驗和注冊資料管理繼續加強
1.繼續開(kāi)展醫療器械臨床試驗監督檢查����。分2批對20個(gè)醫療器械臨床試驗項目進(jìn)行監督檢查����,對16個(gè)注冊項目開(kāi)展臨床試驗樣本真實(shí)性延伸核查����。
2.積極推動(dòng)醫療器械臨床試驗機構備案��。截止2019年底�,全國已有839家臨床試驗機構備案����。對管理者�、項目負責人和臨床試驗技術(shù)人員開(kāi)展三期培訓��。
3.嚴厲打擊提供虛假注冊資料注冊行為�����。根據相關(guān)線(xiàn)索組織對深圳萊福百泰醫療科技有限公司開(kāi)展核查����,對深圳萊福百泰醫療科技有限公司所提交的電子上消化道內窺鏡和電子下消化道內窺鏡兩個(gè)產(chǎn)品不予注冊�����。
?��。┍O管科學(xué)研究穩步推進(jìn)
1.積極推進(jìn)監管科學(xué)研究��。啟動(dòng)中國藥品監管科學(xué)行動(dòng)計劃����。首批啟動(dòng)項目包括藥械組合產(chǎn)品技術(shù)評價(jià)研究��、人工智能醫療器械安全有效性評價(jià)研究����、醫療器械新材料監管科學(xué)研究����、真實(shí)世界數據用于醫療器械臨床評價(jià)的方法學(xué)研究等項目��。在四川大學(xué)���、華南理工大學(xué)設立國家局監管科學(xué)研究基地����,推動(dòng)醫療器械監管科學(xué)研究工作��。
2.推動(dòng)醫療器械臨床真實(shí)世界數據應用試點(diǎn)�。結合監管科學(xué)行動(dòng)計劃項目�����,推動(dòng)臨床真實(shí)世界數據應用試點(diǎn)��,依托重點(diǎn)地區���,制定試點(diǎn)方案�����,確定試點(diǎn)產(chǎn)品�����,制定《真實(shí)世界數據用于醫療器械臨床評價(jià)技術(shù)指導原則》�。
?����。ㄆ撸﹪H交流合作取得實(shí)效
1.國際交流成果豐碩�。參加國際醫療器械監管機構論壇(IMDRF)第16次管理委員會(huì )會(huì )議�����,經(jīng)IMDRF成員國一致同意�����,會(huì )議批準我國牽頭的臨床評價(jià)工作組“臨床證據–關(guān)鍵定義和概念”“臨床評價(jià)”“臨床研究”三份指南文件����,這是自中國加入IMDRF后第一次由中國藥品監管機構牽頭組織編寫(xiě)的指南文件��。管理委員會(huì )同時(shí)贊成中國牽頭的工作組提出的“上市后臨床隨訪(fǎng)研究”擴展項目立項��。管理委員會(huì )一致同意中國加入國家監管機構報告信息交流機制����,與成員國共同分享醫療器械產(chǎn)品相關(guān)安全信息���,共同應對全球醫療器械風(fēng)險挑戰���。此外�,中國作為標準工作組聯(lián)席主席國�,在本次會(huì )議上派代表向管理委員會(huì )和業(yè)界介紹了標準工作組工作進(jìn)展��,研究成果《標準認可和使用情況分析報告》和《認可標準清單》經(jīng)管理委員會(huì )全體成員一致同意通過(guò)�����。
2.參加第24屆亞洲醫療器械法規協(xié)調會(huì )(AHWP)年會(huì )�����。作為AHWP副主席和兩個(gè)工作組主席�,介紹中國醫療器械注冊和監管體系最新進(jìn)展���,主持工作組工作討論和法規協(xié)調工作�,充分發(fā)揮我國在區域醫療器械監管中的作用�����,積極推進(jìn)亞洲法規協(xié)調工作����。
二�、醫療器械注冊申請受理情況
2019年�����,國家藥監局依職責共受理醫療器械首次注冊�、延續注冊和許可事項變更注冊申請9104項��,與2018年相比注冊受理項目增加37.8%����。
?。ㄒ唬┱w情況
受理境內第三類(lèi)醫療器械注冊申請3511項���,受理進(jìn)口醫療器械注冊申請5593項����。
按注冊品種區分���,醫療器械注冊申請5877項�����,體外診斷試劑注冊申請3227項�����。
按注冊形式區分�����,首次注冊申請1693項����,占全部醫療器械注冊申請的18.6%���;延續注冊申請5081項�,占全部醫療器械注冊申請的55.8%��;許可事項變更注冊申請2330項���,占全部醫療器械注冊申請的25.6%�����。注冊形式比例情況見(jiàn)圖1����。

(二)分項情況
1.境內第三類(lèi)醫療器械注冊受理情況
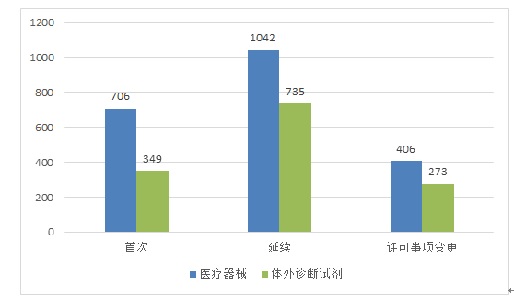
境內第三類(lèi)醫療器械注冊受理共3511項���,與2018年相比大幅增加47.4%�����。其中����,醫療器械注冊申請2154項�,體外診斷試劑注冊申請1357項�。
從注冊形式看�,首次注冊1055項��,占全部境內第三類(lèi)醫療器械注冊申請數量的30.0%�;延續注冊1777項����,占全部境內第三類(lèi)醫療器械注冊申請數量的50.6%���;許可事項變更679項�����,占全部境內第三類(lèi)醫療器械注冊申請數量的19.3%����。注冊形式分布情況見(jiàn)圖2�����。
2.進(jìn)口第二類(lèi)醫療器械注冊受理情況
進(jìn)口第二類(lèi)醫療器械注冊受理共3053項����,與2018年相比增加43.7%���。其中醫療器械注冊申請1559項����,體外診斷試劑注冊申請1494項��。
從注冊形式看���,首次注冊358項���,占全部進(jìn)口第二類(lèi)醫療器械注冊申請數量的11.7%��;延續注冊1847項�����,占全部進(jìn)口第二類(lèi)醫療器械注冊申請數量的60.5%���;許可事項變更848項��,占全部進(jìn)口第二類(lèi)醫療器械注冊申請數量的27.8%�����。注冊形式分布情況見(jiàn)圖3�����。

3.進(jìn)口第三類(lèi)醫療器械注冊受理情況
進(jìn)口第三類(lèi)醫療器械注冊受理共2540項�,與2018年相比增加20.9%����。其中醫療器械注冊申請2164項����,體外診斷試劑注冊申請376項�。
從注冊形式看����,首次注冊280項�����,占全部進(jìn)口第三類(lèi)醫療器械注冊申請數量的11.0%�;延續注冊1457項���,占全部進(jìn)口第三類(lèi)醫療器械注冊申請數量的57.4%��;許可事項變更803項��,占全部進(jìn)口第三類(lèi)醫療器械注冊申請數量的31.6%�����。注冊形式分布情況見(jiàn)圖4�����。

三���、醫療器械注冊審批情況
2019年��,國家藥監局共批準醫療器械首次注冊�、延續注冊和變更注冊8471項�,與2018年相比注冊批準總數量增長(cháng)53.2%��。其中��,首次注冊1726項����,延續注冊4504項�����,許可事項變更2241項��。
2019年����,企業(yè)自行撤回注冊申請210項���,自行注銷(xiāo)注冊證書(shū)66項�。
近6年國家藥監局批準醫療器械注冊情況見(jiàn)圖5�。

(一)整體情況
2019年�����,國家藥監局批準境內第三類(lèi)醫療器械注冊3179項�����,與2018年相比增加86.0%��,進(jìn)口醫療器械5292項��,與2018年相比增加38.6%����。
按照注冊品種區分����,醫療器械5226項�,占全部醫療器械注冊數量的61.7%���;體外診斷試劑3245項���,占全部醫療器械注冊數量的38.3%�����。
按照注冊形式區分����,首次注冊1726項����,占全部醫療器械注冊數量的20.4%����;延續注冊4504項�,占全部醫療器械注冊數量的53.2%��;許可事項變更注冊2241項����,占全部醫療器械注冊數量的26.4%��。注冊形式比例情況見(jiàn)圖6��?��!���。ǘ┓猪椙闆r
1.境內第三類(lèi)醫療器械注冊審批情況
境內第三類(lèi)醫療器械注冊3179項��。其中�����,醫療器械2014項�����,體外診斷試劑1165項��。
從注冊形式看����,首次注冊1067項���,占全部境內第三類(lèi)醫療器械注冊數量的33.6%�,延續注冊1465項�����,占全部境內第三類(lèi)醫療器械注冊數量的46.1%��;許可事項變更注冊647項�����,占全部境內第三類(lèi)醫療器械注冊數量的20.4%��。
2.進(jìn)口第二類(lèi)醫療器械注冊審批情況
進(jìn)口第二類(lèi)醫療器械注冊2754項�����。其中�,醫療器械注冊1521項����,體外診斷試劑注冊1233項��。
從注冊形式看�,首次注冊375項�,占全部進(jìn)口第二類(lèi)醫療器械注冊數量的13.6%���;延續注冊1622項�����,占全部進(jìn)口第二類(lèi)醫療器械注冊數量的58.9%�����;許可事項變更注冊757項�,占全部進(jìn)口第二類(lèi)醫療器械注冊數量的27.5%����。注冊形式分布情況見(jiàn)圖8���。
3.進(jìn)口第三類(lèi)醫療器械注冊審批情況
進(jìn)口第三類(lèi)醫療器械注冊2538項�����。其中��,醫療器械注冊2206項���,體外診斷試劑注冊332項��。
從注冊形式看���,首次注冊284項���,占全部進(jìn)口第三類(lèi)醫療器械注冊數量的11.2%�����;延續注冊1417項���,占全部進(jìn)口第三類(lèi)醫療器械注冊數量的55.8%�����;許可事項變更注冊837項��,占全部進(jìn)口第三類(lèi)醫療器械注冊數量的33.0%�����。注冊形式分布情況見(jiàn)圖9�。
(三)首次注冊項目月度審批情況
2019年���,國家藥監局共批準醫療器械首次注冊1726項����,月度審批情況見(jiàn)圖10�����。
(四)具體批準品種種類(lèi)分析
注冊的境內第三類(lèi)醫療器械���,除體外診斷試劑外�,共涉及《醫療器械分類(lèi)目錄》中19個(gè)子目錄的產(chǎn)品��。
注冊數量前五位的境內第三類(lèi)醫療器械是:無(wú)源植入器械�、注輸�����、護理和防護器械��、神經(jīng)和心血管手術(shù)器械����、醫用成像器械和有源手術(shù)器械�。
注冊的進(jìn)口醫療器械���,除體外診斷試劑外�����,共涉及《醫療器械分類(lèi)目錄》中23個(gè)子目錄的產(chǎn)品���。
注冊數量前五位的進(jìn)口醫療器械�����,主要是:醫用成像器械��、口腔科器械��、無(wú)源植入器械�、臨床檢驗器械��、神經(jīng)和心血管手術(shù)器械�����。
(五)進(jìn)口醫療器械國別情況
2019年��,美國���、德國�、日本�、韓國�、瑞士醫療器械在中國醫療器械進(jìn)口產(chǎn)品首次注冊數量排前5位�,注冊產(chǎn)品數量約占2019年進(jìn)口產(chǎn)品首次注冊總數量的75.4%���,與2018年相比基本持平��。
(六)境內第三類(lèi)醫療器械省份分析
從2019年境內第三類(lèi)醫療器械注冊情況看��,相關(guān)注冊產(chǎn)品生產(chǎn)企業(yè)主要集中在沿海經(jīng)濟較發(fā)達省份���。其中����,江蘇�、北京��、廣東�、上海�����、浙江是境內第三類(lèi)醫療器械首次注冊數量排前五名的省份�����,占2019年境內第三類(lèi)醫療器械首次注冊數量的69.1%����,與2018年相比略有增加����。