關(guān)于公開(kāi)征求《需要進(jìn)行臨床試驗審批的第三類(lèi)醫療器械目錄(2019年修訂版)》意見(jiàn)的通知
發(fā)布日期:2020-02-08 13:36瀏覽次數:3242次
去年年底�,國家藥監局發(fā)布了關(guān)于公開(kāi)征求《需要進(jìn)行臨床試驗審批的第三類(lèi)醫療器械目錄(2019年修訂版)》意見(jiàn)的通知�,極少數風(fēng)險較大�����、安全有效性不確定性程度高的醫療器械臨床試驗需要審批���。
引言:去年年底�����,國家藥監局發(fā)布了關(guān)于公開(kāi)征求《需要進(jìn)行臨床試驗審批的第三類(lèi)醫療器械目錄(2019年修訂版)》意見(jiàn)的通知����,極少數風(fēng)險較大��、安全有效性不確定性程度高的醫療器械臨床試驗需要審批�。
關(guān)于公開(kāi)征求《需要進(jìn)行臨床試驗審批的第三類(lèi)醫療器械目錄(2019年修訂版)》意見(jiàn)的通知
各有關(guān)單位:
為了保護醫療器械臨床試驗受試者安全��,規范臨床試驗審批工作�,保證醫療器械安全性�����、有效性和可及性��,加快產(chǎn)品上市����,我中心對《需要進(jìn)行臨床試驗審批的第三類(lèi)醫療器械目錄》進(jìn)行調整�����,形成2019年修訂版(征求意見(jiàn)稿)(附件1)��,即日起在網(wǎng)上公開(kāi)征求意見(jiàn)����。
衷心希望相關(guān)領(lǐng)域的專(zhuān)家��、學(xué)者和從業(yè)人員提出意見(jiàn)和建議��。如有意見(jiàn)或建議�����,請填寫(xiě)反饋意見(jiàn)表(附件2)�����,并將該表以電子郵件形式于2020年1月31日前反饋至我中心��。
聯(lián)系人:李錚�,閔玥
電 話(huà):010-86452825��,010-86452806
電子郵箱:lizheng@cmde.org.cn minyue@cmde.org.cn
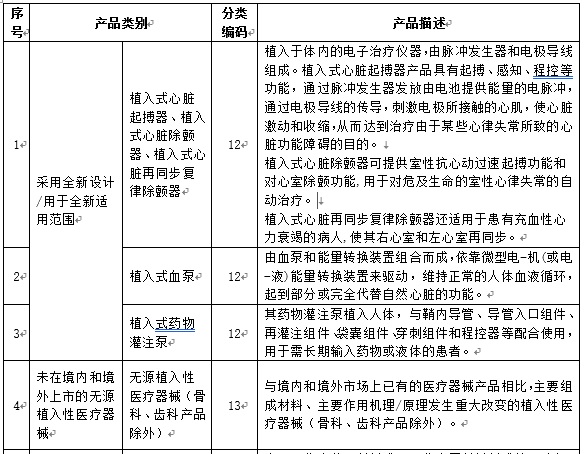
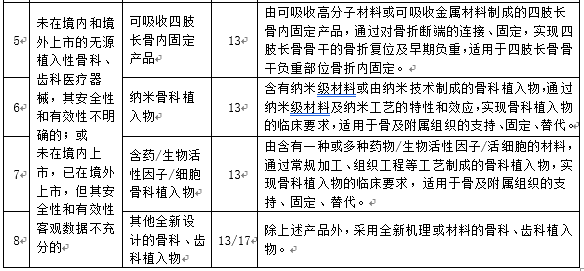
附件:1. 需要進(jìn)行醫療器械臨床試驗審批的第三類(lèi)醫療器械目錄(2019年修訂版)(征求意見(jiàn)稿)
國家藥品監督管理局
醫療器械技術(shù)審評中心
2019年12月23日