對于醫療器械注冊����,如果產(chǎn)品不能豁免臨床的話(huà)�,臨床試驗機構的選擇直接關(guān)系著(zhù)醫療器械注冊進(jìn)程��、時(shí)間��、費用����,以及是否能夠通過(guò)審評�。如何找到有資質(zhì)的臨床試驗機構呢���?我們可以很方便的從醫療器械臨床試驗機構備案管理信息系統中找到符合要求的機構��。
引言:對于醫療器械注冊�����,如果產(chǎn)品不能豁免臨床的話(huà)�,臨床試驗機構的選擇直接關(guān)系著(zhù)醫療器械注冊進(jìn)程����、時(shí)間���、費用����,以及是否能夠通過(guò)審評����。如何找到有資質(zhì)的臨床試驗機構呢��?我們可以很方便的從醫療器械臨床試驗機構備案管理信息系統中找到符合要求的機構�����。
2017年11月24日CFDA和衛計委就聯(lián)合發(fā)布《醫療器械臨床試驗機構條件和備案管理辦法》(2017年第145號)���,把臨床試驗機構的資格認定����,改為備案管理�。
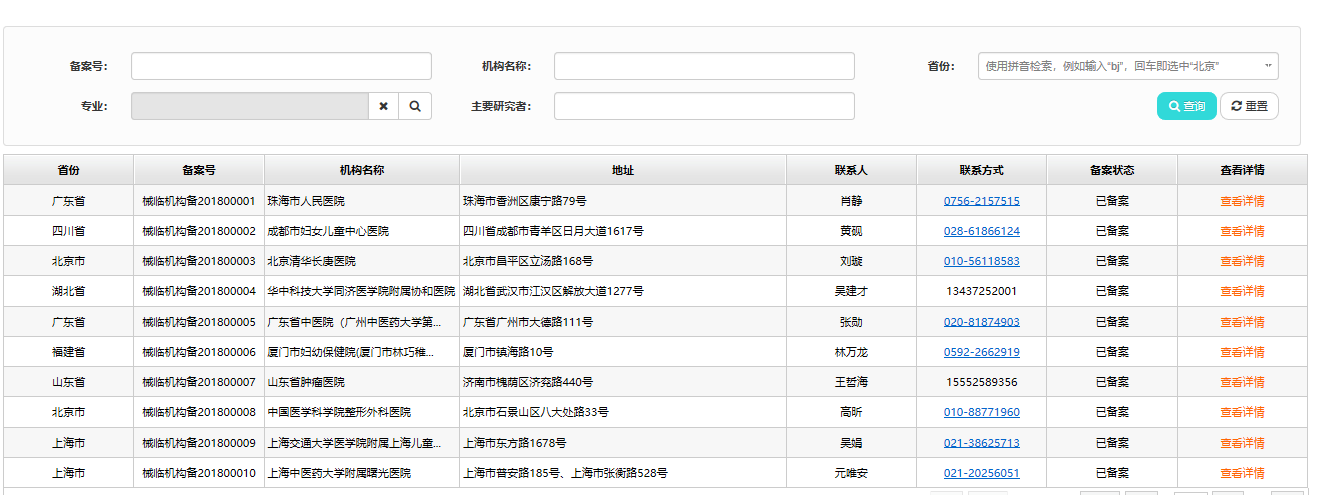
2018年初�,醫療器械臨床試驗機構備案管理信息系統(如下圖)悄然上線(xiàn)�����,我們可以很方便的利用備案號�、省份���、專(zhuān)業(yè)���、主要研究者等字段精準找到符合公司臨床試驗要求的機構�,為進(jìn)一步篩選出合適的臨床試驗機構及PI提供幫助�。
醫療器械臨床試驗備案管理信息系統鏈接如下:
http://218.240.145.213:9000/CTMDS/apps/pub/public.jsp
標簽:醫療器械臨床試驗 臨床試驗機構