子宮輸卵管造影球囊導管通常由導管���、連接件�、保護套管組成���。一般由高分子材料制成�。無(wú)菌提供�����。用于將造影劑注入子宮腔和輸卵管��,進(jìn)行子宮輸卵管造影��。在我國屬于第二類(lèi)醫療器械注冊產(chǎn)品�,一起來(lái)了解子宮輸卵管造影球囊導管注冊要求�。
子宮輸卵管造影球囊導管通常由導管����、連接件����、保護套管組成��。一般由高分子材料制成��。無(wú)菌提供��。用于將造影劑注入子宮腔和輸卵管��,進(jìn)行子宮輸卵管造影���。在我國屬于第二類(lèi)醫療器械注冊產(chǎn)品�,一起來(lái)了解子宮輸卵管造影球囊導管注冊要求��。
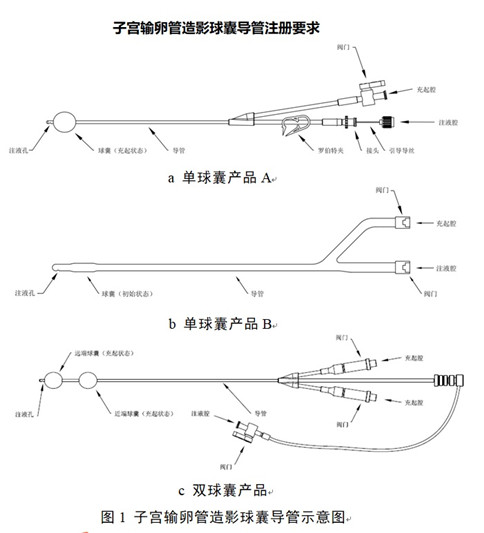
子宮輸卵管造影球囊導管注冊要求及審評要點(diǎn):
1.產(chǎn)品結構組成及工作原理
子宮輸卵管造影球囊導管通常由導管��、球囊�����、閥門(mén)��、接頭等組成����,可配有引導導絲�、羅伯特夾���、球囊充起組件作為配件�����。導管包括充起腔和注液腔����,球囊為單球囊或雙球囊��。導管和球囊一般由高分子材料制成��,如硅橡膠�、乳膠��、聚氯乙烯等��。產(chǎn)品以無(wú)菌形式提供���,一次性使用���。
將產(chǎn)品置入子宮腔���,使產(chǎn)品的球囊位于子宮頸內口的位置���,通過(guò)充起腔給球囊注液膨脹封堵住子宮頸�����,防止造影劑從子宮腔外泄��,再通過(guò)注液腔向子宮腔內注入造影劑�,使子宮腔和輸卵管顯影�,從而了解子宮腔和輸卵管內情況����。
2.產(chǎn)品技術(shù)要求
根據《醫療器械注冊與備案管理辦法》的要求�,產(chǎn)品技術(shù)要求應符合國家標準�����、行業(yè)標準和有關(guān)法律��、法規的要求��。在此基礎上�,申請人應根據產(chǎn)品的特點(diǎn)制定保證產(chǎn)品安全有效�、質(zhì)量可控的技術(shù)要求���。產(chǎn)品技術(shù)要求及試驗方法均應經(jīng)過(guò)驗證�。常見(jiàn)的技術(shù)指標包括但不限于:
2.1外觀(guān)與尺寸
2.1.1外觀(guān)
2.1.2尺寸
2.2物理性能
2.2.1強度
2.2.2球囊可靠性
2.2.3球囊回縮性能/液體回收率
2.2.4耐彎曲性
2.2.6閥門(mén)(如適用)的可靠性
2.2.7接頭(如適用)的要求
2.2.8若含有其他配件���,應制定相應的性能指標���。如:含有球囊充起組件�����,應參考GB 15810中適用部分制定相應性能指標�����。
2.3化學(xué)性能
2.4無(wú)菌
2.5環(huán)氧乙烷殘留(如適用)
3.化學(xué)和物理性能研究
應當提供產(chǎn)品性能研究資料以及產(chǎn)品技術(shù)要求的研究和編制說(shuō)明�����,包括功能性�����、安全性指標(如化學(xué)性能����、物理性能��、微生物性能)的確定依據�,所采用的標準或方法�����、采用原因及理論基礎�����。
4.生物相容性評價(jià)研究
正常使用條件下子宮輸卵管造影球囊導管直接與人體接觸���,應參照GB/T 16886.1《醫療器械生物學(xué)評價(jià) 第1部分:風(fēng)險管理過(guò)程中的評價(jià)與試驗》對子宮輸卵管造影球囊導管進(jìn)行生物學(xué)評價(jià)����,至少進(jìn)行體外細胞毒性�、刺激���、皮膚致敏的生物學(xué)評價(jià)研究���。
生物相容性評價(jià)研究資料應當包括:生物相容性評價(jià)的依據和方法����;產(chǎn)品所用材料的描述及與人體接觸的性質(zhì)�����;實(shí)施或豁免生物學(xué)試驗的理由和論證�����;對于現有數據或試驗結果的評價(jià)�。
5.滅菌工藝研究
提交產(chǎn)品滅菌方法的選擇依據及驗證報告����。器械的滅菌應通過(guò)GB 18279.1���、GB/T 18279.2確認并進(jìn)行常規控制��,無(wú)菌保證水平(SAL)應保證達到1×10-6����。滅菌過(guò)程的選擇應至少考慮以下因素:產(chǎn)品與滅菌過(guò)程的適應性����;包裝材料與滅菌過(guò)程的適應性��;滅菌對產(chǎn)品安全有效性的影響���。
若滅菌使用的方法易出現殘留����,應明確殘留物的名稱(chēng)�、限量及其確定依據�����、采取的處理措施及相應的殘留量檢測報告�����。
6.產(chǎn)品貨架有效期研究
產(chǎn)品貨架有效期是指產(chǎn)品在一定的溫度�、濕度��、光線(xiàn)等條件的影響下保持其物理���、化學(xué)����、生物學(xué)性質(zhì)的期限�����。有效期的研究應貫穿于產(chǎn)品研究與開(kāi)發(fā)的全過(guò)程�����,在產(chǎn)品上市后還應繼續進(jìn)行有效期的研究�。
貨架有效期包括產(chǎn)品有效期和包裝有效期���。產(chǎn)品有效期驗證可采用加速老化或實(shí)時(shí)老化的研究�,應遵循極限試驗等原則�;加速老化研究試驗的具體要求可參考YY/T 0681.1��。
對于包裝的有效期驗證��,建議申請人提交在選擇恰當的材料和包裝結構合格后的最終成品包裝的初始完整性和維持完整性的檢測結果��。在進(jìn)行加速老化試驗研究時(shí)應注意產(chǎn)品選擇的環(huán)境條件的老化機制應與在實(shí)時(shí)正常使用環(huán)境老化條件下真實(shí)發(fā)生產(chǎn)品老化的機制一致�����。
7.包裝研究
產(chǎn)品包裝驗證可依據GB/T 19633�、YY/T 0681系列標準等提交產(chǎn)品的包裝驗證報告�。包裝材料的選擇應至少考慮以下因素:包裝材料的物理化學(xué)性能�����;包裝材料的毒理學(xué)特性��;包裝材料與產(chǎn)品的適應性���;包裝材料與成型和密封過(guò)程的適應性�����;包裝材料與滅菌過(guò)程的適應性��;包裝材料所能提供的物理�、化學(xué)和微生物屏障保護����;包裝材料與使用者使用時(shí)的要求(如無(wú)菌開(kāi)啟)的適應性����;包裝材料與標簽系統的適應性��;包裝材料與貯存運輸過(guò)程的適應性���。