醫療器械唯一標識(UDI)的推廣應用�����,是全球主要經(jīng)濟體醫療器械監管大事件之一�,是醫療器械全生命周期管理的主線(xiàn)之一���。新醫療器械CE認證法規(MDR)的修訂要點(diǎn)��,自然也少不了UDI的要求�����。
引言:醫療器械唯一標識(UDI)的推廣應用��,是全球主要經(jīng)濟體醫療器械監管大事件之一�,是醫療器械全生命周期管理的主線(xiàn)之一��。新醫療器械CE認證法規(MDR)的修訂要點(diǎn)�,自然也少不了UDI的要求����。

一����、什么是UDI��?
Unique device identifiers (UDIs) 器械唯一標識
-UDI 系統是醫療器械數據庫的一部分�,目的是對醫療器械的識別提供一個(gè)全球協(xié)調化的框架����。
-UDI 是基于國際認可的器械標識和編碼標準創(chuàng )建的一系列數字或字母數字, 以便明確識別市場(chǎng)上的特定器械�。
-UDI 由 UDI-DI 和 UDI-PI 組成�����,必須標記在產(chǎn)品標簽�����、包裝或產(chǎn)品上��。UDI-DI 必須登記在醫療器械數據庫中���。

二��、新醫療器械CE認證法規(MDR)有關(guān)UDI的時(shí)間表:
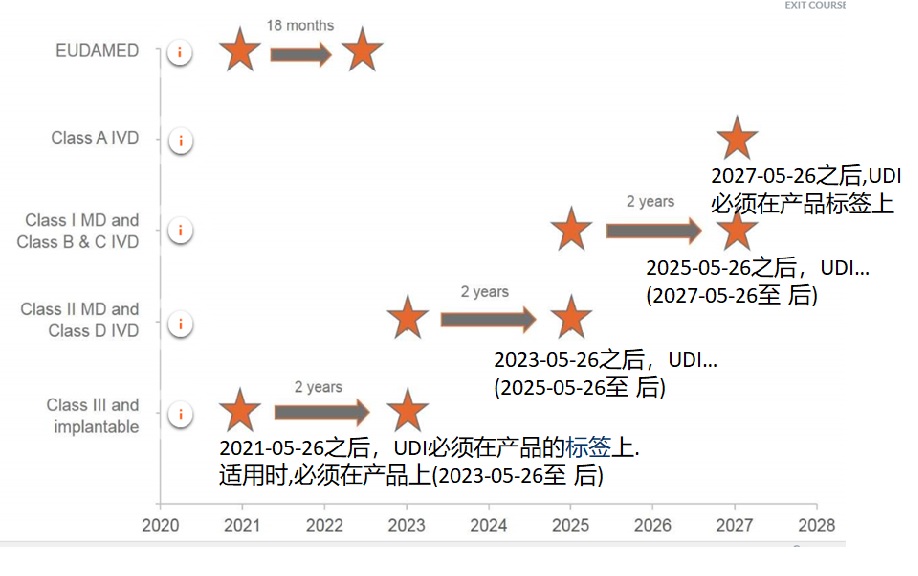
特別提醒的是��,關(guān)注醫療器械CE認證法規要求�����,企業(yè)應該提前做好有關(guān)UDI的準備工作����。