相比MDD,MDR對醫療器械CE技術(shù)文檔及其他資料要求加嚴了許多����,對于醫療器械CE認證?來(lái)說(shuō)���,知悉醫療器械不良事件檢索途徑和方法是必備技能之一�����。
引言:相比MDD,MDR對醫療器械CE技術(shù)文檔及其他資料要求加嚴了許多���,對于醫療器械CE認證來(lái)說(shuō)�����,知悉醫療器械不良事件檢索途徑和方法是必備技能之一�。

隨著(zhù)現代醫療水平的不斷發(fā)展�����,醫療器械已被廣泛地用于疾病的診斷��、預防����、監護���、治療或者緩解等����。但任何被批準上市的醫療器械都不是絕對安全的�����,醫療器械的使用必然帶來(lái)某種程度的風(fēng)險����。已批準上市的醫療器械在正常使用情況下�,會(huì )導致或者可能導致人體傷害的各種有害事件發(fā)生��,各種有害事件的發(fā)生將會(huì )給患者的生命安全帶來(lái)極大威脅���。為降低醫療器械不良事件發(fā)生概率��,建立不良事件監測與評價(jià)體系十分必要���,只有通過(guò)持續開(kāi)展對醫療器械不良事件的監測��,才可以及時(shí)����、有效地發(fā)現不良事件�,為管理部門(mén)對存在安全隱患的產(chǎn)品采取相應的行政措施提供科學(xué)依據�,避免或減少同類(lèi)不良事件在不同時(shí)間���、地點(diǎn)的重復發(fā)生��。
目前很多國家已建立了醫療器械不良事件監測系統���,對于已收集到的不良事件也會(huì )定期公布����,供公眾檢索��。本文匯總了中國NMPA�、美國FDA�����、英國MHRA�����、澳大利亞TGA�、加拿大Health Canada��、日本PMDA�、德國B(niǎo)fArM等國家的醫療器械不良事件檢索方式�����,并提供了對于已檢索到的醫療器械不良事件進(jìn)行匯總分析的方法�,以期為行業(yè)內進(jìn)行醫療器械不良事件監測的人員提供參考����。
一����、醫療器械不良事件監測來(lái)源
?���。ㄒ唬┲袊?/span>
國家藥品不良反應監測中心發(fā)布:
《醫療器械不良事件信息通報》
《醫療器械警戒快訊》
(二)美國
不良事件查詢(xún)數據庫MAUDE
召回查詢(xún)數據庫Recall
按年份查詢(xún)警告信(warning letter)
(三)英國
英國醫療器械警報(MHRA)
(四)加拿大
召回和警戒
(五)澳大利亞TGA
不良事件
召回
警戒
(六)日本PMDA
PMDA網(wǎng)站
(七)德國B(niǎo)fArM
發(fā)布FSCAs(Field Corrective Actions)
二����、醫療器械不良事件監測方向
?��。ㄒ唬┮詳祿鞛榉较?�,開(kāi)展醫療器械不良事件監測工作
開(kāi)展醫療器械不良事件監測可以數據庫為方向��,不同的數據庫有其各自的特點(diǎn)�����,例如中國《醫療器械不良事件信息通報》是國家藥品不良反應監測中心每年定期對某一類(lèi)產(chǎn)品的不良事件進(jìn)行的通報�,而《醫療器械警戒快訊》數據庫中所列不良事件主要收集的是美國FDA���、英國MHRA�����、澳大利亞TGA以及加拿大Health Canada的警示或召回數據�����,并非境內上報數據����;美國MAUDE數據庫屬于全數據庫����,只要按照FDA法規進(jìn)行報告的MDR�����,都會(huì )錄入該數據庫��,但當涉及的檢索結果數據量非常大的時(shí)候�,只能返回500條記錄�,需要通過(guò)限制條件來(lái)精確檢索�;英國MHRA��、加拿大Health Canada��、澳大利亞TGA����、德國B(niǎo)fArM等關(guān)于醫療器械不良事件/召回/警戒信息的數據庫會(huì )定時(shí)更新���,可根據關(guān)鍵詞進(jìn)行進(jìn)一步篩選�,還可通過(guò)限制時(shí)間或限制關(guān)鍵詞的位置等進(jìn)行精確檢索��。
(二)以產(chǎn)品名稱(chēng)為方向���,開(kāi)展醫療器械不良事件監測工作
以產(chǎn)品名稱(chēng)為方向開(kāi)展醫療器械不良事件監測����,可通過(guò)在已選擇的數據庫的檢索頁(yè)面輸入預期要進(jìn)行監測的醫療器械產(chǎn)品名稱(chēng)�,一般不需要輸入太過(guò)具體的產(chǎn)品名稱(chēng)�,例如監測髖關(guān)節假體的不良事件�����,可輸入hip joint���,然后可通過(guò)限制檢索時(shí)間進(jìn)行相關(guān)產(chǎn)品不良事件信息收集�。然而對于美國MAUDE數據庫的檢索��,因其數據量很大�,可進(jìn)一步通過(guò)限制product code進(jìn)行精確檢索�。例如髖關(guān)節產(chǎn)品�����,包含33個(gè)product code�,如全髖關(guān)節置換系統LZO�����;半髖關(guān)節置換系統KWY����;非骨水泥型的髖關(guān)節假體系統OQG�;髖關(guān)節假體系統(不含股骨柄��,骨水泥或非骨水泥)KWZ�����、PBI�����;髖關(guān)節假體(股骨部件)JDG�、KWL�����、LWJ����;髖關(guān)節股骨部件��,表面置換KXA��、NXT��;髖關(guān)節股骨部件����,半髖JDH�;等等�。
(三)以生產(chǎn)企業(yè)名稱(chēng)為方向���,開(kāi)展醫療器械不良事件監測工作
根據醫療器械企業(yè)名稱(chēng)�����,在監測來(lái)源中提及的各大數據庫中通過(guò)企業(yè)名稱(chēng)檢索限定時(shí)間范圍內的醫療器械產(chǎn)品的不良事件信息����,在檢索時(shí)���,尤其是進(jìn)口醫療器械企業(yè)名稱(chēng)���,需要注意其企業(yè)名稱(chēng)的不同表示方式�,例如大小寫(xiě)的區別��,縮寫(xiě)的情況等�。
三�、醫療器械不良事件案例解析
?��。ㄒ唬┽t療器械不良事件監測研究報告
醫療器械不良事件監測研究報告中的內容可包括但不限于如下組成部分:對醫療器械不良事件監測的目的�����,監測計劃等進(jìn)行簡(jiǎn)要概述�;監測數據來(lái)源���;檢索不良事件的時(shí)間范圍����;不良事件數量�;報告來(lái)源�;不良事件發(fā)生原因�����;不良事件的后果�����;如有不良事件分類(lèi)可分別列出以及各自所占的比例���;各類(lèi)不良事件所占的比例��;針對不良事件采取的措施���;該監測數據及監測過(guò)程中的感悟���,如對于技術(shù)審評��,產(chǎn)品上市后監管�,或者生產(chǎn)企業(yè)進(jìn)行風(fēng)險管理等方面的啟示����。
?���。ǘ┽t療器械不良事件案例分析
1.簡(jiǎn)要概述
本文以美國FDA網(wǎng)站MAUDE數據庫為例�,針對全髖關(guān)節置換系統展開(kāi)不良事件檢索��,鑒于數據量很大����,此次通過(guò)限制product code:LZO ����,時(shí)間限定為2019年6月份�,共計檢索出219條信息��,刪除19條非不良事件的信息后���,剩余200條納入分析��。檢索到的關(guān)于LZO全髖關(guān)節置換系統的200條不良事件信息均來(lái)源于生產(chǎn)企業(yè)���,其中199條為Injury傷害�,1條為Malfunction故障����。
2.數據匯總分析方法
將數據庫中的信息進(jìn)行逐一摘錄���,運用Microsoft Excel軟件從報告來(lái)源�����、發(fā)生不良事件的醫療器械相關(guān)信息(包括生產(chǎn)企業(yè)名稱(chēng)���、醫療器械產(chǎn)品名稱(chēng)���、器械類(lèi)型���、器械問(wèn)題)�����、不良事件發(fā)生的時(shí)間���、FDA接收到不良事件的時(shí)間���、事件類(lèi)型����、不良事件發(fā)生原因等方面進(jìn)行數據匯總���。
3.結果分析
3.1總體描述
所檢索到的200條醫療器械不良事件其中111條明確與股骨頭相關(guān)�����,54條明確與股骨柄相關(guān)�����,17條與髖臼外杯相關(guān)(其中4條與髖臼杯上螺釘有關(guān))��,15條與髖臼內襯相關(guān)�����,3條不確定具體引發(fā)不良事件的部件�。具體各類(lèi)別占比情況如圖1所示�。
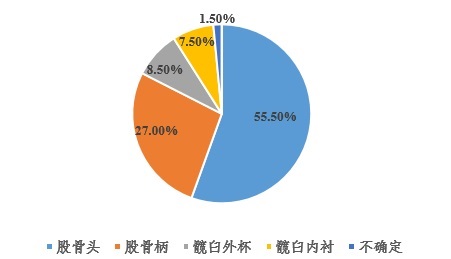
圖1 MAUDE數據庫中全髖關(guān)節假體系統各個(gè)部件出現不良事件占比(基于2019年6月份數據)
收集到的111條由股骨頭部件引發(fā)的不良事件均為術(shù)后發(fā)生���,即患者在行初次髖關(guān)節置換術(shù)后引起的���,其中有79條���,占比71.17%明確進(jìn)行了翻修����。收集到的54條由股骨柄部件引發(fā)的不良事件均為術(shù)后發(fā)生���,其中有49條�����,占比90.74%明確進(jìn)行了翻修�����。收集到的17條由髖臼外杯部件引發(fā)的不良事件有2條為術(shù)中發(fā)生��,包括1條為術(shù)中失血過(guò)多和1條為術(shù)中髖臼螺釘斷裂�。有15條為術(shù)后發(fā)生��,在術(shù)后發(fā)生的15條不良事件中有13條����,占比86.67%�����,明確進(jìn)行了翻修����。收集到的15條由髖臼內襯部件引發(fā)的不良事件均為術(shù)后發(fā)生�����,其中13條�����,占比86.67%���,明確進(jìn)行了翻修����?����;谏鲜鰯祿?��,髖關(guān)節假體置換術(shù)后明確進(jìn)行翻修的比例達到77.78%(其中不包括檢索數據中未明確最終結局的情況)��。
3.2不良事件原因分析及應采取的措施
本文對導致全髖關(guān)節假體系統出現不良事件的主要原因進(jìn)行匯總分析(分析基于現有已檢索數據)����。
3.2.1脫位
其中有59條不良事件引發(fā)的原因包含脫位��,髖關(guān)節假體脫位是髖關(guān)節置換術(shù)后常見(jiàn)的并發(fā)癥之一���,導致術(shù)后假體脫位的常見(jiàn)原因包括:(1)術(shù)后護理不當����,功能鍛煉不當���,術(shù)后患者過(guò)度屈髖����、內旋時(shí)最易發(fā)生���。(2)假體安放位置不當�,特別是髖臼杯安放位置不良�����。(3)關(guān)節周?chē)浗M織松弛或松解過(guò)度�����,特別是臀中肌松弛無(wú)力易發(fā)生�。(4)髖臼假體位置過(guò)高�,股骨頸有效長(cháng)度過(guò)短����,股骨柄內翻�,導致髖關(guān)節周?chē)浗M織張力過(guò)低��,故關(guān)節易脫位��。( 5) 手術(shù)中髖臼周?chē)琴樆蛞绯龅墓撬嗲宄粡氐?��,導致活?dòng)時(shí)由其引起杠桿支點(diǎn)作用���,使股骨頭脫位���。髖臼假體位置不良�����、軟組織不平衡是目前全髖關(guān)節置換術(shù)后早期脫位的主要因素[1]���。當然筆者認為假體脫位也會(huì )與假體的設計有關(guān)�。因此��,術(shù)者應掌握規范的手術(shù)要求及器械的操作技巧���,保證假體選擇合適且安放到位����;也應加強對于患者的臨床康復指導����,提示患者在術(shù)后的注意要點(diǎn)���,防止患者因過(guò)早活動(dòng)或操作不當導致植入物過(guò)早失效����;加強對于護理人員的教育����,如何搬動(dòng)和翻身�,移動(dòng)時(shí)要維持髖關(guān)節伸直��、外展中立位���,避免髖關(guān)節過(guò)度屈曲等���。同時(shí)�,假體研制企業(yè)應加強產(chǎn)品的設計開(kāi)發(fā)流程控制����,確保設計輸出能夠滿(mǎn)足設計輸入的要求�����,設計出結構合理��,性能滿(mǎn)足臨床使用要求���,安全有效的醫療器械產(chǎn)品���。
3.2.2材料腐蝕����,金屬離子濃度升高
其中有38條不良事件是由于髖關(guān)節假體部件材料腐蝕引起的�����,主要發(fā)生在股骨部件���。髖關(guān)節假體界面間磨損產(chǎn)生的顆粒會(huì )釋放金屬離子���,從而導致人體內金屬離子濃度的升高����,可能造成血管炎��、形成炎性假瘤以及軟組織���、產(chǎn)生骨破壞等��,金屬離子濃度升高主要表現為血液中鈷離子濃度和鉻離子濃度的提高�����。有文獻研究顯示[2]���,假體安放位置會(huì )影響假體界面間的磨損程度����,與金屬離子釋放有密切關(guān)系����,尤其是髖臼假體外展角和前傾角對關(guān)節承重和摩擦影響較大��。同時(shí)發(fā)現金屬離子濃度與股骨頭假體直徑成負相關(guān)���,但并不是說(shuō)髖關(guān)節置換術(shù)中必須選擇大直徑假體�����,目前仍要結合患者生理結構的匹配程度進(jìn)行選擇����。
3.2.3感染
其中有21條不良事件是由于感染引起的����。術(shù)后傷口早期感染多因傷口污染所致���,如無(wú)菌操作不規范�,手術(shù)切口暴露時(shí)間長(cháng)�,組織牽拉壓迫損傷重�����,切口沖洗不夠等因素均可導致感染���;此外也可因傷口皮下組織缺血壞死��、血腫����、傷口表淺感染而引起�。晚期感染多因患者機體抵抗力下降�,身體其他部位發(fā)生感染時(shí)細菌經(jīng)血行播散所致[3]�����。因此在進(jìn)行全髖關(guān)節置換術(shù)時(shí)應加強手術(shù)室管理���、注意應嚴格在無(wú)菌環(huán)境下操作�,術(shù)前做好規劃避免手術(shù)切口的長(cháng)時(shí)間暴露�����,充分沖洗切口��,并在術(shù)后做好傷口的引流工作����,使感染率降至最低[4]���。
3.2.4股骨柄松動(dòng)和下沉
其中14條不良事件是由于股骨柄松動(dòng)和下沉引起的����。假體松動(dòng)和下沉是人工髖關(guān)節置換術(shù)后最嚴重的并發(fā)癥之一�����,也是髖關(guān)節翻修術(shù)最常見(jiàn)原因之一�����。導致股骨柄松動(dòng)���、下沉的原因包括:(1)假體固定不牢或保留股骨距過(guò)短��;(2)過(guò)早負重�,骨質(zhì)疏松�;(3)骨水泥聚合不均�����,放置范圍不夠��,骨水泥斷裂����;(4)假體材料不能與骨組織有機結合�;(5)假體磨損�����,微粒形成����,骨溶解或感染����;(6)與手術(shù)者技術(shù)有關(guān)[1]�。因此進(jìn)行髖關(guān)節假體置換術(shù)時(shí)術(shù)者應結合患者生理解剖結構�����,做好術(shù)前規劃��,選擇組織相容性好��、材質(zhì)好且尺寸合適的假體�����;應提高理論及操作技術(shù)���,并在術(shù)前及術(shù)后做好患者及其看護人員的預防性指導工作��。
3.2.5假體周?chē)钦?br/> 其中有6條不良事件是由于假體周?chē)钦垡?����。術(shù)中發(fā)生假體周?chē)钦鄣目赡苄暂^大��,術(shù)中假體周?chē)钦鄢0l(fā)生在轉子區�,多發(fā)生于擴髓或置放假體時(shí)���,與術(shù)中的操作失誤有關(guān)[3]����。避免此類(lèi)骨折需要周密的術(shù)前計劃��,精心的術(shù)前準備�;選擇最合適的假體型號安放�����,應與髓腔相匹配�;擴髓時(shí)依次進(jìn)行�����,置放假體時(shí)應注意假體柄方向與擴髓方向一致�,打擊時(shí)注意保持適當的力量����,切忌粗暴[1]����。
四��、結語(yǔ)
針對醫療器械不良事件原因分析過(guò)程中匯總出的事件發(fā)生原因�����,對于監管部門(mén)����,對于醫療機構��,尤其對于生產(chǎn)企業(yè)在醫療器械風(fēng)險控制方面均具有一定的參考意義���。(一)監管部門(mén)應開(kāi)展醫療器械法規�、規章及規范性文件的制修訂工作��,使得醫療器械有法可依��,有規可循����;應加強醫療器械上市后監管����,定期收集匯總醫療器械在上市后出現的不良事件����、警戒及召回事件�����,并及時(shí)發(fā)布公告�;加強對醫療器械生產(chǎn)企業(yè)的監管�,通過(guò)對醫療器械生產(chǎn)企業(yè)的監管以規范其生產(chǎn)流程�����,從源頭上有效避免不良事件的發(fā)生���;同時(shí)應持續推進(jìn)醫療器械監管科學(xué)研究�,構建基于精準風(fēng)險控制的評價(jià)監管體系����。(二)醫療機構應加強培訓和管理�����,臨床醫生應掌握規范的手術(shù)要求及器械的操作技巧���。應加強醫工結合的作用�����,臨床醫生可就醫療器械在臨床使用過(guò)程中的好或不好的問(wèn)題與器械設計工程師交流�����,使臨床醫生能夠更全面地了解所使用的醫療器械��,也有助于器械設計工程師更好的設計或改進(jìn)醫療器械����。應加強臨床康復指導��,提示患者在術(shù)后的注意要點(diǎn)�,防止患者因過(guò)早活動(dòng)或操作不當導致植入物過(guò)早失效����。同時(shí)應提高臨床醫生對于醫療器械不良事件的認知���,及時(shí)規避醫療器械的使用風(fēng)險����,并能收集和上報醫療器械不良事件���。(三)生產(chǎn)企業(yè)應加強醫療器械產(chǎn)品全生命周期風(fēng)險管控��,充分識別醫療器械產(chǎn)品潛在風(fēng)險����,并采取適當措施將風(fēng)險降低至可接受水平�����。應加強原材料控制���,采用符合標準要求的原材料進(jìn)行醫療器械生產(chǎn)制造����,避免因原材料導致的醫療器械安全有效性問(wèn)題�����。應加強產(chǎn)品的設計開(kāi)發(fā)流程控制���,確保設計輸出能夠滿(mǎn)足設計輸入的要求���,設計出結構合理�,性能滿(mǎn)足臨床使用要求�����,安全有效的醫療器械產(chǎn)品���。應嚴格控制生產(chǎn)環(huán)節的各個(gè)流程��,關(guān)鍵生產(chǎn)工藝經(jīng)過(guò)嚴格的驗證和確認�����,醫療器械產(chǎn)品放行前嚴格把關(guān)��,確保終產(chǎn)品質(zhì)量符合產(chǎn)品技術(shù)要求及臨床使用要求�。