盡管商業(yè)環(huán)境復雜多變�����,盡管很多次真理被假象覆蓋���;盡管很多次被誤解�、被非議�。但是我們一直堅信�、堅持��、堅守對的邏輯���;一直做市場(chǎng)誠信機制守護者��;一直秉持基本的個(gè)人道德����、執業(yè)操守�,及公司信條工作���。感謝藥監總局發(fā)聲����,為市場(chǎng)帶來(lái)官方�、權威的注釋�����。
引言:盡管商業(yè)環(huán)境復雜多變���,盡管很多次真理被假象覆蓋��;盡管很多次被誤解���、被非議����。但是我們一直堅信���、堅持�����、堅守對的邏輯�����;一直做市場(chǎng)誠信機制守護者�;一直秉持基本的個(gè)人道德��、執業(yè)操守�,及公司信條工作��。感謝藥監總局發(fā)聲���,為市場(chǎng)帶來(lái)官方��、權威的注釋�。

口罩等防疫用品出口歐盟及美國市場(chǎng)認證信息指南
為做好新冠肺炎疫情防控和經(jīng)濟社會(huì )發(fā)展工作�����,支持企業(yè)復工復產(chǎn)�����,針對企業(yè)不熟悉防疫物資出口政策等實(shí)際問(wèn)題���,現就口罩等防疫用品出口歐盟及美國的相關(guān)準入要求及梳理的國內具有相應資質(zhì)能力的認證機構名錄提供如下信息指南����,供企業(yè)參考�����。
一�����、歐盟對口罩等防疫用品準入要求
?��。ㄒ唬┛谡?/span>
歐盟根據用途將口罩分為兩類(lèi):醫用口罩和個(gè)人防護口罩�����。
1.醫用口罩
醫用口罩需按照歐盟醫療器械指令93/42/EEC(MDD)或歐盟醫療器械條例EU2017/745(MDR)加貼CE標志���,對應的標準是EN14683�。根據口罩產(chǎn)品無(wú)菌或非無(wú)菌狀態(tài)����,采取的合格評定模式也不同�����。
?��。?)無(wú)菌醫用口罩:必須由授權公告機構進(jìn)行CE認證���。
?����。?)非無(wú)菌醫用口罩:企業(yè)只需進(jìn)行CE自我符合性聲明�,不需要通過(guò)公告機構認證�。在準備好相應文件及測試報告等資料后�,即可自行完成符合性聲明�。
2. 個(gè)人防護口罩
個(gè)人防護口罩不屬于醫療器械���,但需符合歐盟個(gè)人防護設備條例EU2016/425(PPE)要求����,由授權公告機構進(jìn)行CE認證并頒發(fā)證書(shū)��,對應的標準是EN149��。
?�。ǘ┓雷o服
防護服也分為醫用防護服和個(gè)人防護服�,管理要求與口罩基本類(lèi)似����。醫用防護服按照醫療器械管理���,其中無(wú)菌醫用防護服需按照歐盟醫療器械指令93/42/EEC(MDD)或歐盟醫療器械條例EU2017/745(MDR)獲得CE認證��,非無(wú)菌醫用防護服只需進(jìn)行CE自我聲明�。個(gè)人防護服需按照歐盟個(gè)人防護設備條例EU2016/425(PPE)獲得CE認證�����。
?��。ㄈ?歐盟公告機構查詢(xún)地址
1.歐盟醫療器械指令93/42/EEC(MDD)授權的公告機構查詢(xún)地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=13
2.歐盟醫療器械條例EU 2017/745(MDR)授權的公告機構查詢(xún)地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
3.歐盟個(gè)人防護裝備條例EU2016/425(PPE)授權的公告機構查詢(xún)地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=155501
二�、美國對口罩等防疫用品準入要求
?��。ㄒ唬┛谡?/span>
美國對醫用口罩和防護口罩同樣區分管理���,其中醫用口罩由美國食品藥品監督管理局(FDA)管理�,而個(gè)人防護口罩則由美國國家職業(yè)安全衛生研究所(NIOSH)管理����。
1. 醫用口罩
醫用口罩需通過(guò)FDA注冊�,企業(yè)直接向FDA官網(wǎng)申請并提交相關(guān)材料�。此外還有兩種可選途徑:
?����。?)已經(jīng)獲得NIOSH注冊的N95口罩��,在產(chǎn)品生物學(xué)測試���、阻燃測試和血液穿透測試通過(guò)的情況下���,可以豁免產(chǎn)品上市登記(510K)�����,直接進(jìn)行FDA工廠(chǎng)注冊和醫療器械列名���。
?��。?)如果獲得持有510K的制造商的授權�,可以作為其代工廠(chǎng)使用其510K批準號進(jìn)行企業(yè)注冊和器械列名��。
2. 個(gè)人防護口罩
防護口罩需通過(guò)NIOSH注冊����,企業(yè)直接在NIOSH官網(wǎng)申請�。
?。ǘ┓雷o服
對醫用防護服和個(gè)人防護服的管理也類(lèi)似于口罩的管理方式�����,其中醫用防護服由美國食品藥品監督管理局(FDA)管理����,而個(gè)人防護服由美國國家職業(yè)安全衛生研究所(NIOSH)管理����。企業(yè)直接在FDA或NIOSH進(jìn)行注冊申請��。
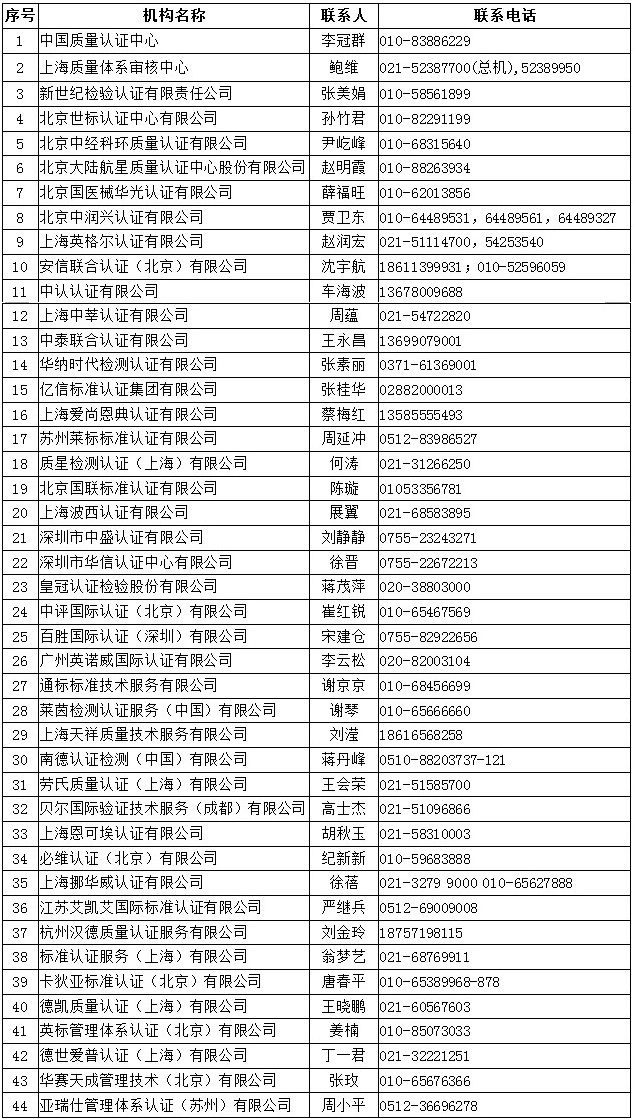
三���、中國境內具有口罩等防疫用品CE認證能力的認證機構名錄

四�����、中國境內可以開(kāi)展醫療器械管理體系(ISO13485)認證的機構名錄
標簽:醫療器械注冊�、醫療器械CE認證���、醫療器械經(jīng)營(yíng)備案