醫療器械獨立軟件注冊產(chǎn)品越來(lái)越多的出現在臨床應用中���,關(guān)于獨立軟件注冊產(chǎn)品的質(zhì)量管理體系���,盡管?chē)揖忠寻l(fā)布GMP規范獨立軟件附錄�����,但仍然是多數企業(yè)薄弱環(huán)節�����。本文為大家帶來(lái)上海醫療器械獨立軟件注冊產(chǎn)品現場(chǎng)核查常見(jiàn)問(wèn)題分析���,無(wú)論是上海醫療器械生產(chǎn)企業(yè)�,還是其它地區醫用軟件生產(chǎn)企業(yè)��,均可以參考本文�,更好的規劃軟件設計開(kāi)發(fā)�����、生產(chǎn)和質(zhì)量保證活動(dòng)�����。
醫療器械獨立軟件注冊產(chǎn)品越來(lái)越多的出現在臨床應用中����,關(guān)于獨立軟件注冊產(chǎn)品的質(zhì)量管理體系�����,盡管?chē)揖忠寻l(fā)布GMP規范獨立軟件附錄�����,但仍然是多數企業(yè)薄弱環(huán)節��。本文為大家帶來(lái)上海醫療器械獨立軟件注冊產(chǎn)品現場(chǎng)核查常見(jiàn)問(wèn)題分析����,無(wú)論是上海醫療器械生產(chǎn)企業(yè)��,還是其它地區醫用軟件生產(chǎn)企業(yè)���,均可以參考本文��,更好的規劃軟件設計開(kāi)發(fā)����、生產(chǎn)和質(zhì)量保證活動(dòng)�。
上海醫療器械獨立軟件注冊產(chǎn)品現場(chǎng)核查常見(jiàn)問(wèn)題分析
一�����、上海醫療器械獨立軟件注冊企業(yè)現場(chǎng)檢查情況
2022年度上海器審中心依據《醫療器械生產(chǎn)質(zhì)量管理規范》(以下簡(jiǎn)稱(chēng)規范)和《醫療器械生產(chǎn)質(zhì)量管理規范附錄獨立軟件》(以下簡(jiǎn)稱(chēng)軟件附錄)對本市醫療器械軟件生產(chǎn)企業(yè)開(kāi)展現場(chǎng)體系核查���,包括注冊質(zhì)量管理體系核查和生產(chǎn)許可現場(chǎng)體系核查�。核查產(chǎn)品涉及醫學(xué)圖像處理���、體外診斷�����、醫學(xué)數據處理等種類(lèi)����。2022年度獨立軟件現場(chǎng)核查共發(fā)現不符合項143項�,其中關(guān)鍵項27項����,一般項116項�。單次檢查發(fā)現不符合項最多為14項�,最少為1項�,其中關(guān)鍵項最多為5項���,最少為0項�。
二�、上海醫療器械獨立軟件注冊企業(yè)現場(chǎng)檢查不符合項分布情況
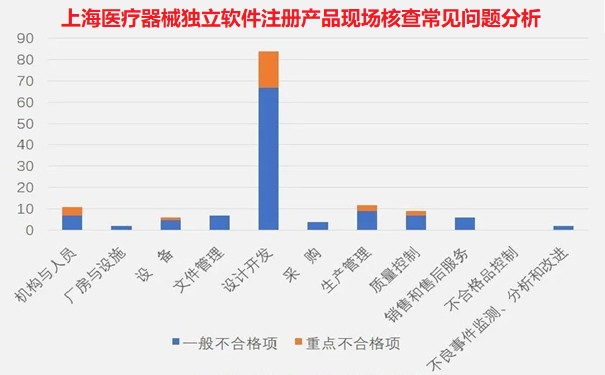
從規范獨立軟件附錄各章節不符合項分布情況(見(jiàn)圖一)來(lái)看���,設計開(kāi)發(fā)占比最多��,不合格品控制無(wú)不合格項�。占前五位的分別為設計開(kāi)發(fā)(59%)�、生產(chǎn)管理(8%)��、機構與人員(8%)�、質(zhì)量管理(6%)和文件與記錄(5%)��。
三�����、上海醫療器械獨立軟件注冊企業(yè)現場(chǎng)核查常見(jiàn)問(wèn)題
通過(guò)分析上述不合格項的數據��,主要存在以下方面問(wèn)題:
(1)軟件需求內容較為簡(jiǎn)單�����,未覆蓋獨立軟件產(chǎn)品部分已實(shí)現功能��,需求規格書(shū)中缺乏對交互界面����、性能���、風(fēng)險分析以及標準要求等相關(guān)內容描述�����。軟件設計未根據軟件需求實(shí)施系統設計����,設計要求不明確或有遺漏�,詳細設計不充分�����。部分企業(yè)對于軟件可追溯性分析要求認識不充分�,未有效實(shí)施貫穿軟件需求�、軟件設計�、軟件測試�����、軟件風(fēng)險等相關(guān)的軟件可追溯性分析����。
(2)軟件測試用例過(guò)于簡(jiǎn)單���,未覆蓋風(fēng)險項����,可操作性差��,測試數據不明確或使用不規范��,導致軟件驗證不充分�����。軟件測試(含單元����、集成以及系統測試)未依據相應測試計劃實(shí)施�����,未形成相應軟件測試報告以及評審記錄����,并未適時(shí)更新�����。
(3)軟件缺陷管理缺乏缺陷分析評估�、軟件缺陷修復����、回歸測試���、風(fēng)險管理�、配置管理�����、評審等活動(dòng)的相關(guān)要求及記錄�����。
(4)未充分識別現成軟件���,現成軟件使用也未按要求形成文件和記錄���。軟件配置管理要求不明確�����,配置管理記錄缺失或不完整��。軟件版本變更未按軟件版本命名規則的進(jìn)行管理變更��。
(5)部分企業(yè)仍存在測試人員與開(kāi)發(fā)人員職責不清���、同一項目開(kāi)發(fā)人員既編碼又承擔黑盒測試的情況��。
(6)獨立軟件交付物的生產(chǎn)及檢驗要求不明確����,相關(guān)記錄缺失或不完整�����。
四����、上海市藥監局對上海醫療器械獨立軟件生產(chǎn)企業(yè)的建議
獨立軟件具有特殊性��,由于需求不明確�����,風(fēng)險分析不充分���,測試不充分�����,會(huì )引發(fā)軟件頻繁變更��,可能導致在產(chǎn)品上市后引起嚴重后果���。通過(guò)對2022年現場(chǎng)檢查不合格項分析����,對于機構與人員�、設計開(kāi)發(fā)��、生產(chǎn)管理和質(zhì)量控制等主要環(huán)節��,提出以下建議:
(1)軟件開(kāi)發(fā)過(guò)程中須明確規定軟件開(kāi)發(fā)人員與測試人員的職責���,避免同一軟件項開(kāi)發(fā)與黑盒測試由一人實(shí)施的情況���。(2)應當基于軟件生存周期過(guò)程控制要求嚴格實(shí)施軟件需求分析���、設計��、驗證及確認等主要軟件開(kāi)發(fā)活動(dòng)����,加強軟件質(zhì)量意識���,提高軟件測試用例質(zhì)量和測試能力���。同時(shí)���,加強對軟件配置管理���、現成軟件使用��、缺陷管理和軟件版本管理等活動(dòng)的控制�。
(3)在生產(chǎn)管理方面�����,應當確保軟件發(fā)布的一致性�����、可重復性��;不同交付方式(物理交付�����、軟件交付)應當明確相應的要求等����。
(4)在質(zhì)量控制方面�����,軟件的放行程序應當明確軟件版本�、完整性檢查等要求和記錄���。
更多有關(guān)上海醫療器械獨立軟件注冊需求���,歡迎您隨時(shí)方便與杭州證標客醫藥技術(shù)咨詢(xún)有限公司聯(lián)絡(luò )�,聯(lián)系人:葉工����,電話(huà):18058734169�����,微信同�。