2021年10月13日����,藥監總局發(fā)布關(guān)于公開(kāi)征求《基因測序儀臨床評價(jià)注冊審查指導原則(征求意見(jiàn)稿)》意見(jiàn)的通知����,基因測序儀產(chǎn)品的醫療器械注冊審評及臨床評價(jià)相關(guān)事項就面向公眾公開(kāi)征求意見(jiàn)����。
2021年10月13日�,藥監總局發(fā)布關(guān)于公開(kāi)征求《基因測序儀臨床評價(jià)注冊審查指導原則(征求意見(jiàn)稿)》意見(jiàn)的通知�����,基因測序儀產(chǎn)品的醫療器械注冊審評及臨床評價(jià)相關(guān)事項就面向公眾公開(kāi)征求意見(jiàn)��。

基因測序儀臨床評價(jià)注冊審查指導原則
(征求意見(jiàn)稿)
本指導原則旨在指導注冊申請人對基因測序儀注冊申報資料的準備及撰寫(xiě)��,同時(shí)也為技術(shù)審評部門(mén)審評注冊申報資料提供參考����。應在遵循相關(guān)法規的前提下使用本指導原則��。
本指導原則是對基因測序儀的一般要求���,申請人應依據產(chǎn)品的具體特性確定其中內容是否適用���。若不適用��,需具體闡述理由并提供相應的科學(xué)依據�����,同時(shí)依據產(chǎn)品的具體特性對注冊申報資料的內容進(jìn)行充實(shí)和細化����。
本指導原則是在現行法規��、標準體系和當前科學(xué)認知水平下制定的�,隨著(zhù)法規�、標準體系的不斷完善和科學(xué)技術(shù)的不斷發(fā)展����,本指導原則相關(guān)內容也將適時(shí)進(jìn)行調整���。
一��、適用范圍
本指導原則適用于高通量測序的基因測序儀采用通過(guò)同品種醫療器械臨床試驗或臨床使用獲得的數據或通過(guò)自身臨床試驗數據進(jìn)行臨床評價(jià)���。
目前高通量基因測序技術(shù)即指第二代測序技術(shù)或下一代測序(Next Generation Sequencing 或NGS)技術(shù)�����,其技術(shù)特征是:(1)通過(guò)測定單元的高度并行化來(lái)實(shí)現高通量(如每次運行獲得數百Mb及Gb序列)�����;(2)由于化學(xué)����、物理等原理的限制��,序列讀長(cháng)較短��,一般在150~200bp(個(gè)別原理可以實(shí)現600bp����,比如焦磷酸測序法)�����;(3)核心技術(shù)成熟���。使用的元件(比如Flow Cell��、硅基陣列�、微流控電導結構等)的加工技術(shù)(一般在微米尺度以上)技術(shù)成熟���,器件結構和性能不具有挑戰性����。其主流平臺包括:(1)DNA聚合酶循環(huán)測序法(單色或多色熒光底物標記)����;(2)DNA連接酶循環(huán)測序法(單色或多色熒光底物標記)���;(3)焦磷酸循環(huán)測序法(原理一:?jiǎn)紊蚨嗌孜餆晒?��;原理二:電學(xué)傳感器)�����?��;谄渌夹g(shù)的基因測序儀產(chǎn)品�����,可參照本指導原則相關(guān)適用條款并結合產(chǎn)品特點(diǎn)準備注冊申報資料�����。
本指導原則適用于申請產(chǎn)品注冊和相關(guān)許可事項變更的產(chǎn)品��。
申請人應當按照《醫療器械臨床評價(jià)技術(shù)指導原則》的要求提交臨床評價(jià)資料�����,選擇通過(guò)同品種醫療器械臨床試驗或臨床使用獲得的數據進(jìn)行分析評價(jià)���,或者臨床試驗這兩種評價(jià)路徑中適用的任一方式�����,提交相應的臨床評價(jià)資料�。
二���、通過(guò)同品種醫療器械臨床試驗或臨床使用獲得的數據進(jìn)行分析評價(jià)要求
(一)同品種基因測序儀判定
注冊申請人可按照通則中“同品種醫療器械”的定義和判定�����,選擇對比產(chǎn)品���,并根據產(chǎn)品特征選擇合適的對比項目���,基于詳實(shí)的研究結果���,分析擬申報產(chǎn)品和同品種產(chǎn)品是否存在差異����。
申請人所選取的同品種基因測序儀���,其與擬申報產(chǎn)品工作原理相同����、關(guān)鍵模塊相同��,其數據質(zhì)量(包含所測序列中每個(gè)堿基的準確度:一般為儀器或分析軟件系統的堿基判定時(shí)特有的質(zhì)量值(quality score))��、一次運行(run)的數據產(chǎn)量(包括平均產(chǎn)量����、最大產(chǎn)量����、產(chǎn)量在質(zhì)量Q值在不同質(zhì)量閾值下的平均產(chǎn)量等)����、測序在一定質(zhì)量閾值下的平均讀長(cháng)(可包括高質(zhì)量的最長(cháng)讀長(cháng)和最短可用讀長(cháng)等)��、儀器指定的不同測序模式��、不同測序模式產(chǎn)生的數據量和運行時(shí)間差異等關(guān)鍵指標���,不應顯著(zhù)差異于擬申報產(chǎn)品�����。
對比項目包括但不限于附件1所列舉的項目�。對比內容包括定性和定量數據���、驗證和確認結果����,應詳述二者的相同性和差異性�,對差異性是否對產(chǎn)品的安全有效性產(chǎn)生不利影響��,應通過(guò)擬申報產(chǎn)品自身的數據進(jìn)行驗證和/或確認���。對于相同性���,也應提交充分的證據��。
(二)擬申報產(chǎn)品與對比產(chǎn)品的評價(jià)關(guān)系
根據《醫療器械臨床評價(jià)技術(shù)指導原則》中規定的評價(jià)路徑可知����,擬申報產(chǎn)品與對比產(chǎn)品關(guān)系有兩種�����,或為同品種產(chǎn)品�,或為非同品種產(chǎn)品�,如為同品種產(chǎn)品�,還需對兩者之間的差異是否對產(chǎn)品安全性����、有效性產(chǎn)生不利影響進(jìn)行進(jìn)一步評價(jià)�����。
針對擬申報產(chǎn)品與對比產(chǎn)品的差異��,注冊申請人需分析差異性是否對產(chǎn)品的安全性和有效性產(chǎn)生不利影響�����,將擬申報產(chǎn)品自身的數據作為支持性資料���,如申報產(chǎn)品的非臨床研究數據���、臨床文獻數據���、臨床經(jīng)驗數據�、針對差異性的臨床試驗數據等��。注冊申請人還需進(jìn)一步評價(jià)差異是否影響性能參數�,以及影響的程度和范圍���,必要時(shí)提供臨床試驗數據進(jìn)行確認��。
針對申報產(chǎn)品的生化原理(包括但不限于酶學(xué)反應�、信號發(fā)生����、信號源強度等)����、物理原理(包括但不限于信號采集部件�����、光源����、濾光器件等)�、堿基質(zhì)量判斷軟件(包括但不限于堿基判斷算法����、核心數據集��、錯誤率評估�、系統弱點(diǎn)評估等)�����、系統集成原理和性能(包括但不限于:系統結構�、核心模塊��、系統操控軟件��、操控人需求�、可靠性等)等基本性能等通過(guò)功能測試過(guò)程與同品種產(chǎn)品進(jìn)行對比�。
與同品種產(chǎn)品相比�,申報產(chǎn)品的性能指標�����、數據質(zhì)量不低于對比產(chǎn)品時(shí)��,可認為申報產(chǎn)品基本符合同品種產(chǎn)品預期的臨床應用要求����;若申報產(chǎn)品的關(guān)鍵模塊�����、產(chǎn)品結構�、主要功能等與同品種產(chǎn)品具有顯著(zhù)差異�,且該差異影響申報產(chǎn)品的性能指標����,尤其是影響數據質(zhì)量時(shí)�,注冊申請人還需開(kāi)展對應差異的臨床試驗�����,對申報產(chǎn)品性能是否滿(mǎn)足臨床使用需要進(jìn)行確認��。
不同情形評價(jià)關(guān)系所需提交的支持性資料不盡相同���,具體內容見(jiàn)表1�,表1給出的具體情況舉例可能不能涵蓋所有情況��,申請人應根據擬申報產(chǎn)品的具體情況進(jìn)行列舉和判定����,并給出判定的具體理由��。
表1 擬申報產(chǎn)品與對比產(chǎn)品關(guān)系及需提交資料類(lèi)型表
擬申報產(chǎn)品與對比產(chǎn)品關(guān)系 | 擬申報產(chǎn)品與對比產(chǎn)品差異類(lèi)型 | 具體情況舉例 | 需提交 資料類(lèi)型 |
屬于同品種(差異評價(jià)路徑可參考附件3) | 通常提交非臨床研究可能充分證明的差異 | 1.擬申報產(chǎn)品適用范圍不超出對比產(chǎn)品�����。 2.擬申報產(chǎn)品芯片密度與對比產(chǎn)品相當���,僅數量不一致��,后期信號數據處理基本一致���。 3.擬申報產(chǎn)品流動(dòng)槽支架的性能與對比產(chǎn)品不一致�����。 4.擬申報產(chǎn)品流體自動(dòng)化模塊的性能與對比產(chǎn)品不一致��。 5.擬申報產(chǎn)品緩沖劑吸管裝置的性能與對比產(chǎn)品不一致���。 以上差異未造成性能差異和數據質(zhì)量下降�。 | 通常提交非臨床研究可能充分證明的差異:非臨床研究�����、和/或臨床文獻數據����、和/或臨床經(jīng)驗數據 |
需要提交臨床試驗資料的差異 | 1.擬申報產(chǎn)品適用范圍多于對比產(chǎn)品��。 2.擬申報產(chǎn)品軟件組件的主要功能����、核心算法(信號采集�����、信號建模�����、信號糾錯等)與對比產(chǎn)品不一致�����。 3.擬申報產(chǎn)品芯片設計構架�、密度及后期信號數據處理等關(guān)鍵功能有較大差異���。 | 針對差異的臨床試驗資料 |
不屬于同品種 |
| 1.擬申報產(chǎn)品的工作原理與對比產(chǎn)品不相同���。 2.擬申報產(chǎn)品的檢測原理和判讀方法與對比產(chǎn)品不相同���。 3.擬申報產(chǎn)品的使用環(huán)境與對比產(chǎn)品不相同�。如臺式��、便攜式與落地式��。 4.擬申報產(chǎn)品關(guān)鍵模塊的原理與對比產(chǎn)品不一致����。如成像模塊的原理不一致�����。 5.擬申報產(chǎn)品的性能與對比產(chǎn)品差異較大����。 | 重新選擇同品種產(chǎn)品進(jìn)行比較或補充針對產(chǎn)品的臨床試驗資料 |
(三)證明差異對產(chǎn)品的安全性��、有效性未產(chǎn)生不利影響的支持性資料(臨床經(jīng)驗數據�����、臨床文獻數據���、非臨床研究等)
支持性資料中應明確說(shuō)明擬申報產(chǎn)品與同品種基因測序儀的差異����;詳細說(shuō)明針對擬申報產(chǎn)品與同品種基因測序儀的差異進(jìn)行的研究方式及研究結果�,提供的研究證據應證明擬申報產(chǎn)品與同品種基因測序儀的差異對產(chǎn)品臨床使用的安全性和有效性帶來(lái)的收益/影響��。
1.申請人應當完整地列出擬申報產(chǎn)品與同品種基因測序儀的所有差異點(diǎn)����,并說(shuō)明這些差異點(diǎn)的相互關(guān)系�。若不同差異點(diǎn)之間存在相關(guān)性或相互影響����,則應提供單個(gè)差異點(diǎn)影響的研究證據和關(guān)聯(lián)性差異點(diǎn)共存時(shí)影響的研究證據��。
2.申請人應當根據擬申報產(chǎn)品與同品種基因測序儀的具體差異點(diǎn)提供相應的支持性資料�,資料的類(lèi)型和數量應根據擬申報產(chǎn)品和對比產(chǎn)品的差異點(diǎn)對產(chǎn)品安全性�����、有效性的影響進(jìn)行確定���。
(四)針對差異性的非臨床研究資料
根據擬申報產(chǎn)品與同品種產(chǎn)品的差異性分析�,申請人應當對擬申報產(chǎn)品與對比產(chǎn)品的差異性及各差異點(diǎn)對產(chǎn)品安全性和有效性的影響進(jìn)行全面評估���,針對差異分別列出所進(jìn)行的非臨床研究的內容和結果��,包括但不僅限內部研究資料或驗證報告等���。
基于擬申報產(chǎn)品和同品種基因測序儀的對比結果����,如果非臨床研究���、臨床文獻數據�、臨床經(jīng)驗數據等無(wú)法充分地證明該差異對產(chǎn)品安全性和有效性的影響��,則申請人應提供相應的臨床試驗資料�����。
(五)針對適用范圍項目的對比��,應提供的臨床數據
針對適用范圍項目的對比����,相同點(diǎn)應提交同品種產(chǎn)品的臨床數據以及申報產(chǎn)品的非臨床數據作為支持性資料���,對于較同品種產(chǎn)品增加的適用范圍�,應提交申報產(chǎn)品的臨床試驗數據�,同時(shí)可提交其他支持性資料����。
支持性資料為臨床文獻數據時(shí)����,申請人應根據擬申報產(chǎn)品與同品種產(chǎn)品的差異點(diǎn)���,合理選擇臨床文獻數據庫�����,準確設置檢索詞��,進(jìn)行全面的科學(xué)文獻檢索���,完成文獻檢索和篩選方案���、文獻檢索和篩選報告����。
支持性資料為臨床經(jīng)驗數據時(shí)����,在綜合考慮��、科學(xué)分析擬申報產(chǎn)品與同品種產(chǎn)品差異的基礎上�,可提供臨床經(jīng)驗數據收集內容�,包括對已完成的臨床試驗���、不良事件��、與臨床風(fēng)險相關(guān)的糾正措施等數據的收集��。
臨床文獻和經(jīng)驗數據的支持性資料應重點(diǎn)分析適用范圍項目的對比�。其中可應用于臨床項目應考慮選擇不同變異類(lèi)型���、不同核酸類(lèi)型的檢測項目�����。并充分分析項目中的數據質(zhì)量�����。對于數據質(zhì)量進(jìn)行比較和充分評價(jià)�。
支持性資料����、同品種醫療器械臨床使用獲得的數據的收集����、同品種醫療器械臨床數據分析評價(jià)方法��、臨床評價(jià)報告撰寫(xiě)等方面的具體內容可參照《醫療器械臨床評價(jià)技術(shù)指導原則》的相關(guān)規定����。
三���、臨床試驗路徑
臨床試驗的開(kāi)展�、方案的制定以及報告的撰寫(xiě)均應符合相關(guān)法規及《醫療器械臨床評價(jià)技術(shù)指導原則》的要求��,如相關(guān)法規��、文件有更新���,臨床試驗應符合更新后的要求�。下面僅說(shuō)明該類(lèi)產(chǎn)品臨床試驗中應關(guān)注的重點(diǎn)問(wèn)題�����。
(一)臨床試驗機構
應選擇不少于兩家(含兩家)符合要求的臨床試驗機構開(kāi)展臨床試驗����。臨床試驗機構應具備相應的檢測資質(zhì)和人員����。
(二)臨床試驗目的及設計
1. 臨床試驗目的
證明申報產(chǎn)品與已上市同類(lèi)產(chǎn)品臨床性能的一致性���。
2.對比方法的選擇
對于已有同類(lèi)產(chǎn)品上市的臨床研究���,可以選擇臨床參考方法或已在中國境內上市的同類(lèi)產(chǎn)品作為對照��。如選同類(lèi)產(chǎn)品作為對照�,建議選擇目前在臨床檢測方面使用狀況良好的機型���,應注意申報產(chǎn)品的適用范圍不應超過(guò)同類(lèi)產(chǎn)品的適用范圍���,同時(shí)應提供對照產(chǎn)品的信息�,如生產(chǎn)企業(yè)�、型號�、適用范圍等���。如申報產(chǎn)品的適用范圍超過(guò)已批準上市同類(lèi)產(chǎn)品���,則可與同類(lèi)產(chǎn)品作為對照對相同的適用范圍進(jìn)行評價(jià)��,并應另外選擇臨床參考方法作為對比方法����,對超出同類(lèi)產(chǎn)品的適用范圍進(jìn)行臨床評價(jià)��。
對于無(wú)同類(lèi)已上市產(chǎn)品的臨床研究�,可選擇臨床參考方法作為對比方法進(jìn)行比較研究�����,以評價(jià)申報產(chǎn)品的臨床性能��。
臨床試驗中還應對申報產(chǎn)品和對照產(chǎn)品/方法檢測結果不一致樣本進(jìn)行分析�����,以明確結果不一致的原因����。
臨床參考方法可委托第三方機構檢測��,但應在臨床試驗方案中予以明確�。
3.驗證項目的選擇
應根據申報產(chǎn)品所聲稱(chēng)的適用范圍�����,選擇代表性的檢測項目進(jìn)行臨床評價(jià)����,同時(shí)應考慮到不同樣本類(lèi)型���。
如申報產(chǎn)品的適用范圍為對來(lái)源于人體樣本的人脫氧核糖核酸(DNA)進(jìn)行測序�,以檢測基因序列變化����。至少應選擇人類(lèi)基因靶向測序以及非靶向測序項目進(jìn)行評價(jià)����。其中人類(lèi)基因靶向測序���,建議選擇腫瘤組織的基因突變?yōu)閷ο?���,應包括代表性的突變?lèi)型�����,如點(diǎn)突變���、小片段的插入/缺失����、拷貝數變化����。如適用范圍還包括核糖核酸(RNA)的測序��,即將RNA逆轉錄成DNA后進(jìn)行測序��,則還應對基因融合(如ALK融合)進(jìn)行驗證����。
如申報產(chǎn)品的適用范圍不限于人DNA���,則應增加病原體檢測項目��,不建議采用宏基因組測序的方式進(jìn)行臨床試驗����。病原體應來(lái)自于人體樣本�,包括病毒�����、細菌����、真菌等�,每種類(lèi)別各選一種代表性項目進(jìn)行評價(jià)�����。如同時(shí)包括RNA���,則還應選擇至少一種RNA病原體進(jìn)行評價(jià)���。
應根據臨床試驗中所選擇的臨床項目����,制定受試者的選擇標準���,即入選和排除標準����。同時(shí)受試者年齡����、性別分布應均衡合理���,充分考慮人種��、地域差異對試驗結果的影響��。
4. 臨床評價(jià)指標
主要評價(jià)指標一般為檢測準確性(靈敏度���、特異度)或檢測一致性(陽(yáng)性/陰性符合率����、總符合率����、Kappa值等)����,主要評價(jià)指標應能夠滿(mǎn)足評價(jià)產(chǎn)品臨床性能的要求���。
次要評價(jià)指標一般包括儀器功能�、穩定性����、使用便捷性����、使用安全性等�。
同時(shí)申請人還應對臨床試驗檢測項目進(jìn)行數據質(zhì)量的分析�。
5.樣本量估算
為實(shí)現樣本代替總體的目的�����,臨床試驗需要一定的受試者數量(樣本量)����。樣本量一般以臨床試驗的主要評價(jià)指標進(jìn)行估算���。需在臨床試驗方案中說(shuō)明樣本量估算的相關(guān)要素及其確定依據����、樣本量的具體計算方法�。主要評價(jià)指標的相關(guān)參數根據已有臨床數據和小樣本可行性試驗(如有)的結果來(lái)估算��,需要在臨床試驗方案中明確這些估計值的確定依據�。一般情況下����,Ⅰ類(lèi)錯誤概率α設定為雙側0.05或單側0.025��,Ⅱ類(lèi)錯誤概率β設定為不大于0.2�,預期受試者脫落和方案違背的比例不大于0.2���,申請人可根據產(chǎn)品特征和試驗設計的具體情形采用不同的取值�,需充分論證其合理性���。
如臨床試驗采用申報產(chǎn)品與已上市同類(lèi)產(chǎn)品進(jìn)行比較研究的試驗設計��,建議采用單組目標值法樣本量公式估算最低樣本量�����。
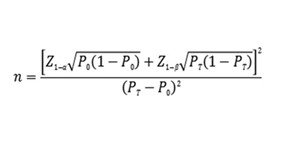
公式中�,n為樣本量���;Z1-α�����、Z1-β為顯著(zhù)性水平和把握度的標準正態(tài)分布的分數位����,P0為評價(jià)指標的臨床可接受標準���,PT為試驗用體外診斷試劑評價(jià)指標預期值�����。
對于所選擇進(jìn)行臨床驗證的代表性項目大類(lèi)�����,如人類(lèi)基因靶向測序�����,總樣本量應滿(mǎn)足統計學(xué)要求���,其中每種代表性的突變類(lèi)型均應有一定例數����。
臨床試驗中如采用多中心臨床����,則所有中心臨床樣本總數應滿(mǎn)足統計學(xué)要求����,如采用非多中心臨床����,則每家臨床機構樣本量應均滿(mǎn)足統計學(xué)要求����。
6.統計分析
應選擇合適的統計方法對臨床試驗結果進(jìn)行統計分析�����,對于申報產(chǎn)品與參考方法/已上市同類(lèi)產(chǎn)品的一致性評價(jià)���,一般選擇2×2表的形式總結兩種產(chǎn)品的檢測結果���,并據此計算靈敏度/特異度�����、陽(yáng)性/陰性符合率��、Kappa值等指標及其95%置信區間�。
對于不一致樣本�,應進(jìn)行原因分析����。如臨床試驗方案規定采用其他方法進(jìn)行確認�����,則確認結果不應納入統計分析��。
(三)質(zhì)量控制
臨床試驗開(kāi)始前��,建議進(jìn)行臨床試驗的預試驗��,以熟悉并掌握相關(guān)試驗方法的操作����、儀器�、技術(shù)性能等����,最大限度控制試驗誤差���。整個(gè)試驗過(guò)程都應處于有效的質(zhì)量控制下�����,最大限度保證試驗數據的準確性及可重復性�。
五�����、決策是否開(kāi)展醫療器械臨床試驗
對于具有下列情形之一的產(chǎn)品�����,通過(guò)同品種醫療器械臨床試驗或臨床使用獲得的數據進(jìn)行分析評價(jià)無(wú)法充分證明產(chǎn)品安全性����、有效性的�,應當進(jìn)行臨床試驗��,包括:
1.擬申報產(chǎn)品或擬申報產(chǎn)品的某關(guān)鍵模塊(含軟件)具有全新的技術(shù)特性��,或者數據質(zhì)量具有顯著(zhù)差異����。
2.擬申報產(chǎn)品具有新的臨床預期使用場(chǎng)景和功能��,且該功能從未在境內獲得批準���。
3.針對與同品種醫療器械之間的差異���,若不能通過(guò)非臨床研究數據���、臨床應用數據等證據資料證明申報產(chǎn)品的安全性和有效性���,申請人需要考慮通過(guò)臨床試驗來(lái)獲得臨床數據�。
具體決策是否開(kāi)展醫療器械臨床試驗可參照附件2和附件3�����,并提供充分的依據����。
六�、參考文獻
[1]《醫療器械臨床評價(jià)技術(shù)指導原則》(2015年第14號通告)
[2] YY/T 1723-2020《高通量基因測序儀》[S]
七��、起草單位
起草單位:國家藥品監督管理局醫療器械技術(shù)審評中心
附件:1. 擬申報產(chǎn)品與同品種基因測序儀對比表
2. 同品種比對路徑
3. 基因測序儀同品種比對差異評價(jià)路徑
附件1
擬申報產(chǎn)品與同品種基因測序儀對比表
1.基本原理
1.1擬申報產(chǎn)品和同品種產(chǎn)品的工作原理應一致����。應詳述核心結構模塊和原理���,包括:樣本來(lái)源和處理(包括片段化����、定向擴增����、定向捕獲或純化等)����、生化原理(包括催化酶���、底物標記����、熒光化學(xué)�����、試劑保存�、硅基表面處理等)����、物理原理(光學(xué)或電學(xué)模塊并行化�、信號采集���、信號處理���、液路設計���、廢液收集處理等)����、堿基判斷和質(zhì)量評估原理(包括信號采集處理��、質(zhì)量評估���、序列組裝等核心算法和軟件來(lái)源)等���。
1.2產(chǎn)品類(lèi)型應明確臺式����、便攜式���、大型儀器��。
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
|
|
基本原理 | 1.1 | 工作原理 |
|
|
|
|
|
|
1.1.1 | 生化原理 |
|
|
|
|
|
|
1.1.2 | 物理原理 |
|
|
|
|
|
|
1.1.3 | 信號放大和采集原理 |
|
|
|
|
|
|
1.1.4 | 信號處理原理(信號建模���、轉換�、糾錯) |
|
|
|
|
|
|
| 1.1.5 | 堿基識別和質(zhì)量評估原理 |
|
|
|
|
|
|
| 1.1.6 | 高通量���、并行化原理 |
|
|
|
|
|
|
| 1.1.7 | 液路系統 |
|
|
|
|
|
|
| 1.1.8 | 信號放大和采集原理 |
|
|
|
|
|
|
|
| ... |
|
|
|
|
|
|
| 1.2 | 產(chǎn)品類(lèi)型 |
|
|
|
|
|
|
2.結構組成
2.1產(chǎn)品組成應包括描述申報產(chǎn)品的所有結構組成�。對成像模塊����、流動(dòng)槽支架�����、流體自動(dòng)化模塊����、緩沖劑吸管裝置等功能模塊�、主體模塊等核心結構模塊進(jìn)行逐項詳細比對�。
2.2核心部件應至少對加樣裝置�����、恒溫反應裝置�����、芯片����、信號采集��、檢測器及其原件技術(shù)要求進(jìn)行對比�。
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
|
|
結構組成 | 2.1 | 產(chǎn)品組成 |
|
|
|
|
|
|
|
| ... |
|
|
|
|
|
|
2.2 | 核心部件 |
|
|
|
|
|
|
2.2.1 | 流體液路系統 |
|
|
|
|
|
|
2.2.2 | 恒溫反應裝置 |
|
|
|
|
|
|
| 2.2.3 | 芯片設計構架 |
|
|
|
|
|
|
| 2.2.4 | 恒溫反應裝置 |
|
|
|
|
|
|
| 2.2.5 | 信號采集處理裝置 |
|
|
|
|
|
|
|
| ... |
|
|
|
|
|
|
3.性能要求
3.1性能參數應包括 最大數據量/run*run����,reads長(cháng)度���,突變類(lèi)型以及人與病原體的檢測性能�����,并對數據質(zhì)量進(jìn)行充分評價(jià)����。
3.2反應模式及時(shí)間應包括所有的反應模式如PE150����,PE250���,SE35等�。
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
|
|
性能要求 | 3.1 | 性能參數 |
|
|
|
|
|
|
3.2 | 功能參數 |
|
|
|
|
|
|
|
| 反應模式及用時(shí) |
|
|
|
|
|
|
|
| ... |
|
|
|
|
|
|
4.軟件核心功能及算法
4.1對比產(chǎn)品的軟件核心功能及算法
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
|
|
軟件核心功能 | 4.1 | 運行控制 |
|
|
|
|
|
|
4.2 | 狀態(tài)監控 |
|
|
|
|
|
|
| 4.3 | 堿基識別 |
|
|
|
|
|
|
| 4.4 | 數據質(zhì)控 |
|
|
|
|
|
|
| 4.5 | 結果判讀 |
|
|
|
|
|
|
|
| ... |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5.適用范圍及預期用途
5.1樣本類(lèi)型通常包括血清�、全血�����、組織�����、FFPE及其他含有人類(lèi)以及各種病原體的核酸的樣本類(lèi)型等�����,可采用代表性樣本類(lèi)型(根據樣本中基因組特征)����。
5.2變異類(lèi)型通常包括點(diǎn)突變����、插入缺少���、結構變異等變異類(lèi)型���。
5.3檢測的核酸樣本類(lèi)型通常包括人類(lèi)基因組DNA�、細胞內RNA���、細胞外循環(huán)DNA或RNA�����,病原體DNA或RNA等���。所有各類(lèi)不同來(lái)源的RNA均須逆轉錄成互補DNA后才能用于測序����。
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
|
|
適用范圍預期用途 | 5.1 | 預期用途 |
|
|
|
|
|
|
5.2 | 代表性樣本類(lèi)型 |
|
|
|
|
|
|
5.3 | 可完成試驗項目 |
|
|
|
|
|
|
5.4 | 變異類(lèi)型 |
|
|
|
|
|
|
5.5 | 檢測的核酸類(lèi)型 |
|
|
|
|
|
|
5.6 | 使用環(huán)境 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.配套要求
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
|
|
配套要求 | 6.1 | 上機文庫質(zhì)量要求 |
|
|
|
|
|
|
6.2 | 樣本來(lái)源和處理(包括片段化����、定向擴增�����、定向捕獲或純化等) |
|
|
|
|
|
|
| 6.3 | 配套使用的測序通用試劑要求 |
|
|
|
|
|
|
|
| ... |
|
|
|
|
|
|
7.安全性評價(jià)
安全性 評價(jià) | 7.1 | 通用電氣安全 |
|
|
|
|
|
7.2 | 專(zhuān)用安全 |
|
|
|
|
|
| 7.3 | 網(wǎng)絡(luò )安全 |
|
|
|
|
|
8.其他
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
8 | 標簽 |
|
|
|
|
|
9 | 產(chǎn)品說(shuō)明書(shū) |
|
|
|
|
|
10 | 禁忌癥 |
|
|
|
|
|
11 | 防范措施和警告 |
|
|
|
|
|
12 | 產(chǎn)品符合的國家/行業(yè)標準 |
|
|
|
|
|
| ... |
|
|
|
|
|
以上所列出的內容為擬申報產(chǎn)品與同品種基因測序儀對比需要具體考慮的事項��,申請人可根據產(chǎn)品特點(diǎn)增加對比項目�。