2019年12月31日���,國家藥品監督管理局發(fā)布通告稱(chēng)���,在對廣西雙健科技有限公司的飛行檢查中�,發(fā)現該企業(yè)質(zhì)量管理體系存在諸多缺陷�,責令該企業(yè)立即停產(chǎn)整改�。
引言:2019醫療器械飛檢| 停產(chǎn)整改15家���,高風(fēng)險產(chǎn)品仍是重點(diǎn)��。

2019年12月31日�,國家藥品監督管理局發(fā)布通告稱(chēng)�,在對廣西雙健科技有限公司的飛行檢查中�����,發(fā)現該企業(yè)質(zhì)量管理體系存在諸多缺陷����,責令該企業(yè)立即停產(chǎn)整改��。
近年來(lái)����,在大力深化審評審批制度改革的同時(shí)����,監管部門(mén)不斷加大政策合規管控力度��,飛行檢查成為最有力的監管手段之一����。2019年12月中旬����,在中國醫療器械行業(yè)協(xié)會(huì )2019產(chǎn)業(yè)年會(huì )上���,國家藥監局審核查驗中心有關(guān)人員對2019年醫療器械飛檢情進(jìn)行了分析��。
一�、國家藥監總局醫療器械飛檢不合格者超過(guò)五成
監管風(fēng)險和問(wèn)題導向是醫療器械飛行檢查的總體原則���,尤其是2019年����,國家藥監局在高風(fēng)險產(chǎn)品監管方面有所調整��。截至2019年12月14日�����,國家藥監局核查中心共組織40個(gè)檢查組���,選派了122人次檢查員�����,對80家醫療器械生產(chǎn)企業(yè)進(jìn)行了飛行檢查���。其中����,多年或多品種國抽不合格42家(占比53%)��,投訴舉報5家(占比6%)��,不良事件1家(占比1%)����,合規檢查32家(占比40%)�����。
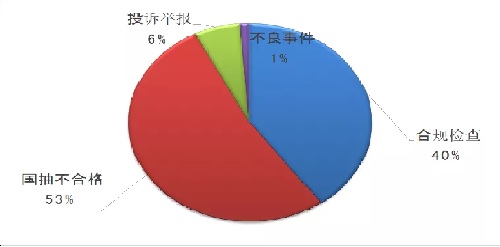
根據國抽的數據和分析���,在2019年的飛行檢查中�����,來(lái)自抽樣不合格的占53%����。從國家監管角度來(lái)講�����,2019年是改革第一年�,因此把抽樣作為重點(diǎn)����,2020年可能會(huì )有調整���。整個(gè)品種的分配��,基本還是無(wú)源和植入的高風(fēng)險產(chǎn)品占主導��,這類(lèi)品種占比過(guò)半���。
二��、總局醫療器械飛檢發(fā)現企業(yè)主體責任意識仍待加強
2019年醫療器械飛檢的結果如下:立案查處企業(yè)1家�;停產(chǎn)整改企業(yè)15家����;限期整改企業(yè)40家��;檢查期間��,產(chǎn)品停產(chǎn)整改企業(yè)18家�����;注銷(xiāo)產(chǎn)品注冊證3家���;注銷(xiāo)生產(chǎn)許可證3家����。其中��,被責令停產(chǎn)整改的��,在國家藥監局官網(wǎng)進(jìn)行公告��;限期整改的�,在核查中心網(wǎng)站“醫療器械檢查專(zhuān)欄”公開(kāi)����。
檢查結果����。
從癥結分析方面來(lái)看�����,2018年飛行檢查90家���,2019年為80家�����,雖然比上年少了一些��,但確確實(shí)實(shí)偏重于高風(fēng)險產(chǎn)品�,包括投訴舉報��、不良事件�����、抽樣不合格等等��,其實(shí)代表著(zhù)企業(yè)或多或少存在各種問(wèn)題�����。有些是企業(yè)對相關(guān)條款不太理解����,而有些則是企業(yè)存有僥幸心理�����,認為抽檢是小概率���,只要沒(méi)抽到就不用關(guān)注�。
《醫療器械生產(chǎn)質(zhì)量管理規范》第三條規定�����,企業(yè)應當按照本規范的要求,結合產(chǎn)品特點(diǎn)����,建立健全與所生產(chǎn)醫療器械相適應的質(zhì)量管理體系���,并保證其有效運行���。也就是說(shuō)�,實(shí)施規范的主體責任是企業(yè)�����,企業(yè)應該增加責任意識���、質(zhì)量意識和風(fēng)險意識�����,產(chǎn)品的風(fēng)險降低了���,監管的風(fēng)險也就降低了��。在質(zhì)量理念方面�,整個(gè)產(chǎn)品生命周期都要圍繞風(fēng)險管理���,包括怎么正確理解《規范》�����,對于規范的嚴格要求怎么靈活把握���,靈活性���、具體方法和操作措施有N多個(gè)�����,可以根據自己產(chǎn)品的實(shí)際情況和本身的能力����,在原則性要求下靈活處理��,以達到醫療器械產(chǎn)品安全����、有效�、合規的目的����。
關(guān)于質(zhì)量評審����,《醫療器械監督管理條例》特別明確���,醫療器械生產(chǎn)企業(yè)應當定期對質(zhì)量管理體系的運行情況進(jìn)行自查����,并向所在地省�、自治區��、直轄市人民政府食品藥品監督管理部門(mén)提交自查報告����。內審相當于一個(gè)診斷或者健康體檢的措施�,每年做一次���,實(shí)際上過(guò)程中不同模塊都可以做�,包括持續改進(jìn)����,它能促進(jìn)企業(yè)生產(chǎn)質(zhì)量管理體系的不斷完善�����,企業(yè)應該重視起來(lái)����。